
【题目】钙和铜合金可用作电解制钙的阴极电极材料,回答下列问题:
(1)基态铜原子的价电子排布式为_________________。
(2)CaCO3高温分解可制得CaO。CaO与 C 在一定条件下可生成CaC2,CaC2与水反应生成 Ca(OH)2和一种 4 原子气体分子。
①CaCO3中阴离子的空间构型为______________。
②该气体分子中 σ 键与π键的数目之比为_____________。
③写出 2 种与 ![]() 互为等电子体的分子的化学式______________。
互为等电子体的分子的化学式______________。
(3)工业上电解 CaCl2制Ca而不采用电解 CaO 的原因是_______________。
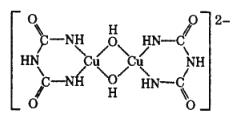
(4)在碱性溶液中,缩二脲 HN( CONH2)2与 CuSO4反应得到一种特征紫色物质,其结构如图所示,该反应原理可用于检验蛋白质或其他含键的化合物。缩二脲分子中碳原子与氮原子的杂化类型分别为__________、________。
(5)一种钙铜合金的结构可看作图a、b 两种原子层交替堆积排列而成c,其晶胞如图d。
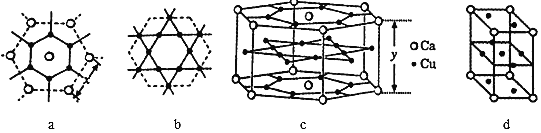
①a图Ca-Ca 间距离为x pm,c图中Ca-Ca间距离为y pm。已知原子拥有的尽可能多的相邻原子的个数叫该原子的配位数,则晶胞c中Ca原子的配位数(Cu原子)为_______。
②设阿伏加德罗常数的值为 NA,则该钙铜合金的密度是_______gcm-3(列出计算表达式)。
【答案】3d104s1 平面三角形 3:2 CO、N2 CaO熔点高于CaCl2,熔化时消耗能量高 sp2 sp3 18 ![]()
【解析】
(1)根据基态Cu原子的外围电子排布为写出价电子排布式;
(2)①CaCO3中K2CO3中阴离子为CO32-,中心碳原子形成1个碳氧双键和2个碳氧单键,阴离子的空间构型为平面三角形;
②该气体为C2H2,分子中2个单键,1个三键,一个单键就有一个σ键,三键中有一个σ键和2个π键;
③![]() 离子中共有14个电子;
离子中共有14个电子;
(3) CaO熔点高于CaCl2,熔化时消耗能量高;
(4)缩二脲分子中碳原子以单键和双键结合与氮原子以单键结合;
(5)①以上面面心上的Ca原子为例,该晶胞中该Ca原子配位的Cu原子包含其上面6个、相同层6个、下层6个,所以其配位数是18;
②根据均摊法求出一个晶胞的质量和体积,再根据![]() =
=![]() 计算晶体密度。
计算晶体密度。
(1)基态Cu原子的外围电子排布为:3d104s1,则基态Cu原子的价电子排布式为3d104s1,故答案为:3d104s1;
(2)①CaCO3中K2CO3中阴离子为CO32-,中心碳原子形成1个碳氧双键和2个碳氧单键,阴离子的空间构型为平面三角形,故答案为:平面三角形;
②该气体为C2H2,分子中2个单键,1个三键,一个单键就有一个σ键,三键中有一个σ键和2个π键,分子中σ键与π键数目比为3:2,故答案为:3:2;
③![]() 离子中共有14个电子,符合的有CO、N2,故答案为:CO、N2;
离子中共有14个电子,符合的有CO、N2,故答案为:CO、N2;
(3)氧化钙熔点比氯化钙熔点高,熔融离子晶体要消耗能源,从而增加成本,为减少成本,所以用熔融氯化钙冶炼钙,故答案为:CaO熔点高于CaCl2,熔化时消耗能量高;
(4)缩二脲分子中碳原子以单键和双键结合,分子中的C原子采取sp2杂化,氮原子以单键结合分子中的N原子采取sp3杂化,故答案为:sp2;sp3;
(5)①以上面面心上的Ca原子为例,该晶胞中该Ca原子配位的Cu原子包含其上面6个、相同层6个、下层6个,所以其配位数是18,故答案为:18;
②根据c可知,该晶胞中Ca原子个数=12×![]() +2×
+2×![]() =3、Cu原子个数=12×
=3、Cu原子个数=12×![]() +6×
+6×![]() +6=15,该晶胞体积=[
+6=15,该晶胞体积=[![]() (x×10-10)2sin60°×6× (x×10-10)]cm3=
(x×10-10)2sin60°×6× (x×10-10)]cm3=![]() x2y×10-30cm3,晶体密度=
x2y×10-30cm3,晶体密度=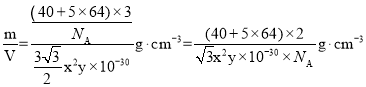 ,故答案为:
,故答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】将5 mL 0.005 mol·L-1的FeCl3溶液与5 mL0.01 mol·L-1的KSCN溶液混合,建立平衡:FeCl3+3KSCN![]() 3KCl+Fe(SCN)3(红色)。
3KCl+Fe(SCN)3(红色)。
(1)若滴加饱和FeCl3溶液4滴,平衡向________方向移动,溶液红色________。
(2)若滴加1 mol·L-1KSCN溶液4滴,平衡向________方向移动,溶液红色________。
(3)若滴加0.01 mol·L-1NaOH溶液4滴,则产生____ (填颜色)沉淀,c(Fe3+)___,平衡向______方向移动,溶液红色________。
(4)若加入少量KCl固体,则平衡________移动,原因________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从八角茴香中提取的莽草酸,是合成治疗禽流感的药物——达菲( Tamiflu) 的原料之一。其结构简式如图,下列有关莽草酸分子的说法正确的是
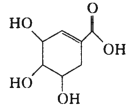
A.含有两种不同的官能团
B.7个碳原子共面
C.1mol能与4molNaOH 完全反应
D.既能使 Br2的CCl4溶液褪色 ,又能使酸性KMnO4溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用 0.1molL-1NaOH溶液滴定 20 mL 0.1 molL-1 某二元弱酸 H2A ( Ka1 =1.1×10-3,Ka2= 3.9×10-6 )溶液,滴定过程中溶液的 pH 变化曲线如图所示。下列说法正确的是
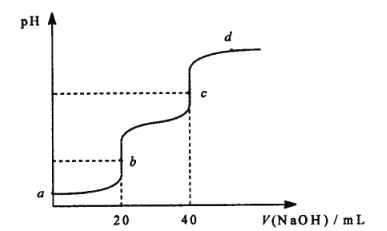
A.a 点的pH 大于2
B.b 点溶液中c(H2A) > c(A2-)
C.c 点溶液中c( HA-) + 2c(H2A ) = c( OH- )-c(H+)
D.d 点溶液中c (Na+) +c(H+) =c(A2-) +c(HA-) +c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制500mL 0.100 mol·Lˉ1的NaCl溶液,部分实验操作示意图如下:
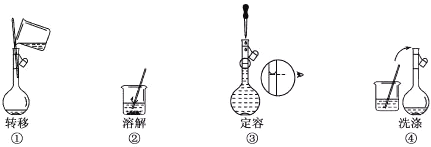
下列说法正确的是
A. 实验中需用的仪器有:天平、250mL容量瓶、烧杯、玻璃棒、胶头滴管等
B. 上述实验操作步骤的正确顺序为①②④③
C. 容量瓶需要用自来水、蒸馏水洗涤,干燥后才可用
D. 定容时,仰视容量瓶的刻度线,使配得的NaCl溶液浓度偏低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式,书写正确的是( )
A.盐酸与石灰石反应:CO32ˉ+2H+ = CO2↑+H2O
B.铁与稀盐酸反应:2Fe+6H+ = 2Fe3++3H2↑
C.氢氧化铁胶体的制备:FeCl3 + 3H2O = Fe(OH)3+3HCl
D.硫酸铜溶液中滴加氢氧化钡溶液:Ba2++2OH-+Cu2++SO42ˉ = BaSO4↓+Cu(OH)2↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2﹣羟基异丁酸乙酯能溶于水,是一种应用于有机合成和药物制造的化工原料。

(1)2﹣羟基异丁酸乙酯的分子式为_________,不同化学环境的氢在核磁共振氢谱图中有不同的吸收峰,则2﹣羟基异丁酸乙酯有_________个吸收峰;
(2)①②的反应类型分别为_________,_________;
(3)已知I为溴代烃,I→B的化学方程式为_________;
(4)缩聚产物F的结构简式为_________;
(5)下列关于![]() 和
和 的说法正确的有_________(双选,填字母);
的说法正确的有_________(双选,填字母);
A.后者遇到FeCl3溶液显紫色,而前者不可
B.两者都可以与NaHCO3溶液反应放出CO2
C.两者都可以与氢氧化钠溶液发生反应,当两者物质的量相等时,消耗氢氧化钠的量不相等
D.两者都可以与氢气发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述中正确的是( )
A. 1 L 1 mol/L的Na2CO3溶液中含有的CO32-数目为![]()
B. 常温常压下,8 g O2含有的电子数是4NA
C. 标准状况下,2.24 L CCl4中含有的分子数为0.1NA
D. 25℃时,1 L pH=13的 Ba(OH)2溶液中含有的OH-数目为0.2![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2O5是一种新型硝化剂,在一定温度下可发生如下反应:2N2O5(g)![]() 4NO2(g) + O2(g) △H >0。T1温度时,向密闭容器中通入N2O5气体,部分实验数据见下表:
4NO2(g) + O2(g) △H >0。T1温度时,向密闭容器中通入N2O5气体,部分实验数据见下表:
时间/s | 0 | 500 | 1000 | 1500 |
c(N2O5)/(mol·L-1) | 5.00 | 3.52 | 2.50 | 2.50 |
下列说法正确的是
A.500 s内NO2的生成速率为2.96×10-3mol·L-1·s-1
B.T1温度下该反应平衡时N2O5的转化率为29.6%
C.达到平衡后,其他条件不变,将容器的体积压缩到原来的1/2,则c(N2O5)﹤5.00mol/L
D.T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1>K2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com