
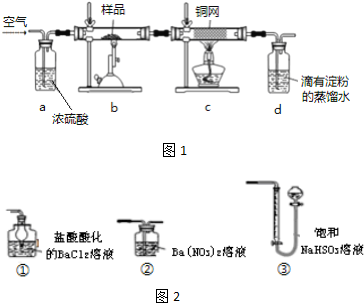
分析 该实验原理是:根据黄铜矿受热分解产生的二氧化硫的量的测定(二氧化硫可以用碘水来标定),结合元素守恒可以确定黄铜矿的量,进而计算其纯度.
(1)根据样品称量的精确度来分析;增大固体的表面积可以加快化学反应速率;
(2)浓硫酸可以将水除去,还可以根据冒出气泡的速率来调节空气流速;灼热的铜网可以除去多余的氧气;
(3)根据反应结束时的颜色变化判断滴定终点,当达到滴定终点时,二氧化硫已经被碘单质消耗完毕,再滴入一滴碘单质,遇到淀粉会变蓝,;
(4)二氧化硫全部被吸收是实验成败的关键;
(5)根据滴定管的读数方法和要求来回答判断;
(6)图2中的②中通入二氧化硫,反应生成了硫酸钡沉淀,可以根据硫酸钡的质量计算二氧化硫的量;
(7)二氧化碳和二氧化硫均可以和氢氧化钡反应生成白色沉淀,亚硫酸钡易被氧化为硫酸钡.
解答 解:该实验原理是:根据黄铜矿受热分解产生的二氧化硫的量的测定(二氧化硫可以用碘水来标定),结合元素守恒可以确定黄铜矿的量,进而计算其纯度.
(1)将样品研细后再反应,即增大固体的表面积,目的是使原料充分反应、加快反应速率,
故答案为:增大接触面积,使原料充分反应、加快反应速率;
(2)装置a中的浓硫酸可易吸收空气中的水蒸气,同时根据冒出的气泡的速率来控制气体的通入量;灼热的铜网可以除去多余的氧气,
故答案为:bd;e;
(3)当达到滴定终点时,二氧化硫已经被碘单质消耗完毕,再滴入一滴碘单质,遇到淀粉会变蓝且半分钟不褪色,证明反应达到反应终点,
故答案为:锥形瓶中的溶液由无色变为蓝色且半分钟不褪色,
(4)黄铜矿受热分解生成二氧化硫等一系列产物,分解完毕后仍然通入空气,可以将产生的二氧化硫全部排出去,使结果精确,
故答案为:使反应生成的SO2全部进入d装置中,使结果精确;
(5)根据滴定管的示数是上方小,下方大,可以读出滴定管示数是20.00mL,当达到滴定终点时,二氧化硫已经被碘单质消耗完毕,再滴入一滴碘单质,遇到淀粉会变蓝,根据反应实质,得到:2I2~2SO2~CuFeS2,消耗掉0.05mol/L标准碘溶液20.00mL时,即消耗的碘单质的量为:0.05mol/L×0.02L=0.0010mol,所以黄铜矿的质量是:0.5×0.0010mol×184g/mol×10=0.92g,所以其纯度是:$\frac{0.92g}{1.84g}$×100%=50%,
故答案为:50%;
(6)由于图2中,②硝酸钡溶液中通入二氧化硫能够生成硫酸钡沉淀,过滤干燥后,根据硫酸钡的质量计算出二氧化硫的质量,
故答案为:②;
(7)空气中的CO2与Ba(OH)2反应可以生成BaCO3沉淀,此外BaSO3被氧化成BaSO4均可以导致所以的沉淀的量比二氧化硫和氢氧化钡反应生成的白色沉淀的量多,
故答案为:空气中的CO2与Ba(OH)2反应生成BaCO3沉淀,BaSO3被氧化成BaSO4.
点评 本题考查了探究黄铜矿的纯度,涉及了仪器选择、纯度计算等知识,题量较大,充分考查了学生分析和解决问题的能力,本题难度中等.


科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl | B. | NaNO2 | C. | NaNO3 | D. | BaSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 电导率传感器能用于判断酸碱中和滴定的终点 | |
| B. | 该过程中,a点所示溶液的导电性最强 | |
| C. | c点电导率最小是因为此时溶液中导电微粒数目最少 | |
| D. | d点所示溶液中存在:c(Cl-)+c(OH-)=c(H+)+c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯(SO2、H2O):碱石灰,洗气 | B. | 乙烷(乙烯):酸性 KMnO4,洗气 | ||
| C. | 炭粉(MnO2):热的浓盐酸,过滤 | D. | Cl2(HCl):饱和食盐水,洗气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某新型航天服材料主要成分是由碳化硅、陶瓷和碳纤维复合而成,它是一种新型无机非金属材料 | |
| B. | 玛瑙饰品的主要成分与建筑材料砂子相同 | |
| C. | 明矾净水时发生了化学及物理变化,能起到净水作用,而没有杀菌、消毒的作用 | |
| D. | 医用酒精是利用了乙醇的氧化性来杀菌消毒的 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Al(OH)2 | Zn(OH)2 |
| 开始沉淀时的pH | 2.7 | 7.5 | 5.4 | 4.0 | 6.4 |
| 完全沉淀时的pH | 3.7 | 9.5 | 6.6 | 5.2 | 8.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com