
设NA为阿伏加德罗常数的值。下列说法正确的是
A.常温下,0.05 mol·L-1Fe2(SO4)3溶液中含Fe3+数目为0.1 NA
B.标准状况下,22.4L甲苯中含C—H数目为8 NA
C.常温、常压下,1.6g O2和O3混合物中,氧原子的数目为0.1NA
D.0.1mol Na2O2与足量CO2反应时,转移的电子数目为0.2 NA
 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源: 题型:
下列有关滴定操作的顺序正确的是
①用标准溶液润洗滴定管②往滴定管内注入标准溶液③检查滴定管是否漏水④滴定⑤洗涤
A. ⑤①②③④ B. ③⑤①②④
C. ⑤②③①④ D. ②①③⑤④
查看答案和解析>>
科目:高中化学 来源: 题型:
某CuSO4、Fe2(SO4)3、H2SO4的混合溶液100 mL,已知溶液中阳离子的浓度相同,且SO42- 的物质的量浓度为6 mol·L-1,则此溶液最多溶解铁粉的质量为( )
A.5.6 g
B.11.2 g
C.22.4 g
D.33.6 g
查看答案和解析>>
科目:高中化学 来源: 题型:
霉酚酸酯(MMF)是器官移植中抑制细胞增殖最常用的药物,它在酸性溶液中能发生如下反应:

下列说法中正确的是
A.MMF分子中含有三种官能团
B.可以用NaHCO3溶液区别MMF与化合物Ⅰ
C.化合物Ⅱ分子中只含碳、氢元素,属于烃类
D.1molMMF与足量NaOH 溶液共热,最多可消耗3molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上用白云石制备高纯氧化镁的工艺流程如下:
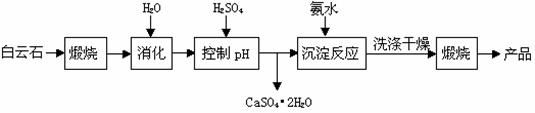
已知白云石的主要成分可表示为:
CaO 32.50%;MgO 20.58%;Fe2O3 2.18%;SiO2 0.96%;其他 43.78%
(1)为了提高白云石的煅烧效果,可以采取的措施是 ▲ 。
若在实验室中煅烧白云石,需要的仪器除酒精灯、三脚架以外,还需要 ▲ 。
A.蒸发皿 B.坩埚 C.泥三角 D.石棉网
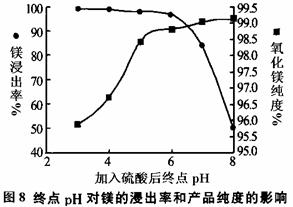
(2)加入H2SO4控制pH时,终点pH对产品的影响如图8所示,pH过高会导致镁浸率降低,其原因为 ▲ ,pH过低对产品影响是 ▲ 。

(3)从溶液中获得CaSO4·2H2O的操作是蒸发浓缩、 ▲ 、过滤、洗涤、干燥。
(4)写出沉淀反应中的离子方程式: ▲ 。
检验沉淀是否洗净的方法是: ▲ 。
(5)沉淀反应过程中,温度对产品的纯度也有一定的影响。图9为反应温度对氧化镁纯度的影响。最终确定本反应的适宜温度为 ▲
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关化学实验的叙述正确的是( )
A.用待测液润洗滴定用的锥形瓶
B.滴定管洗净后经蒸馏水润洗,即可注入标准液进行滴定
C.玻璃棒蘸取溶液滴到放在表面皿上的pH试纸上
D.Na2CO3溶液保存在带玻璃塞的试剂瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺流程如下:

请同答下列问题:
(l)写出向KOH溶液中通入足量Cl2发生反应的离子方程式_______ 。
(2)在溶液I中加入KOH固体的目的是______(填编号)。
A. 为下一步反应提供碱性的环境
B.使KClO3转化为KClO
C.与溶液I中过量的Cl2继续反应,生成更多的KClO
D. KOH固体溶解时会放出较多的热量,有利于提高反应速率
(3)从溶液Ⅱ中分离出K2FeO4后,还会有副产品KNO3,KCl,则反应③中发生的离子反应方程式为_______。每制得59.4克K2FeO4,理论上消耗氧化剂的物质的量为____ mol。
(4)高铁酸钾(K2FeO4)作为水处理剂的一个优点是能与水反应生成胶体吸附杂质,配平该反应的离子方程式:_______ FeO42-+_______ H2O=_______ Fe(OH)3(胶体)+_______O2↑+_______OH-。
(5)从环境保护的角度看,制备K2FeO4较好的方法为电解法,
其装置如右图所示。电解过程中阳极的电极反应式为________。
(6)高铁电池是一种新型二次电池,电解液为碱溶液,其反应式为:
3Zn(OH)2+2Fe(OH)3+4KOH-----3Zn+2K2FeO4+8H2O,放电时电池
的负极反应式为________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com