
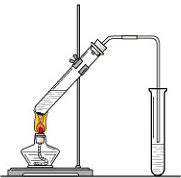
 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题: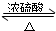 CH3COOC2H5+H2O,
CH3COOC2H5+H2O,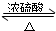 CH3COOC2H5+H2O.
CH3COOC2H5+H2O.


科目:高中化学 来源: 题型:
| A、原子及其离子的核外电子层数等于该元素所在的周期数 |
| B、元素周期表中从ⅢB到ⅡB族10个纵行的元素都是金属元素 |
| C、稀有气体原子的最外层电子数都是8 |
| D、同一元素的各种同位素的物理性质、化学性质均相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将2molSO3气体通入一密闭容器中,达平衡后吸收QkJ热量,则该反应的热化学方程式为:2SO3(g)?2SO2(g)+O2(g)△H=+QkJ/mol |
| B、将少量SO2气体通入NaClO溶液中:SO2+H2O+2ClO-=SO32-+2HClO |
| C、NH4Al(SO4)2溶液中加入Ba(OH)2溶液使SO42-完全沉淀:Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O |
| D、向含有0.4molFeBr2的溶液中通入0.3molCl2充分反应:4Fe2++2Br-+3Cl2=4Fe3++6Cl-+Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
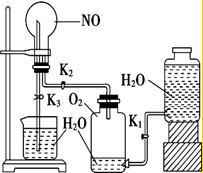 某学生设计了一套验证物质化学性质的实验装置(如图),请观察该装置图,完成下列问题:
某学生设计了一套验证物质化学性质的实验装置(如图),请观察该装置图,完成下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
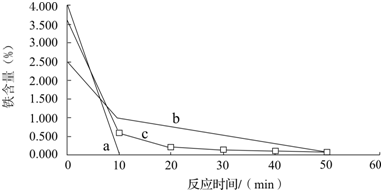
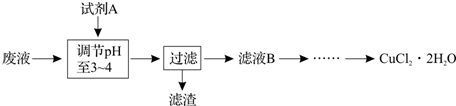
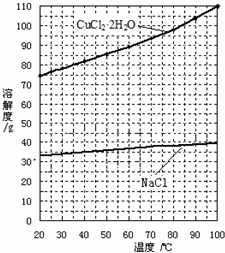
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| △ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com