
分析 (1)根据电子守恒和原子守恒来配平化学方程式;
(2)氧化还原反应中,化合价升高元素失去电子,化合价降低元素对应的产物是还原产物,根据化学方程式来计算反应转移电子的量;
(3)根据化学方程式中硝酸根离子和金属铝之间的关系来计算回答.
解答 解:(1)氯元素化合价共升高了3价,两氮元素化合价共降低了10价,根据得失电子守恒,则需要转移电子30mol,所以金属铝的前面系数是10,硝酸根前面系数是6,氮气前面系数是3,根据原子守恒配平氢原子和氧原子即可,即
6NO3-+10Al+18H2O═3N2↑+10Al(OH)3+6OH-,故答案为:6、10、18H2O、3、10、6;
(2)氧化还原反应中,得电子的物质化合价降低,是NO2-,化合价升高的Al元素对应的产物Al(OH)3是氧化产物,根据化学方程式可以知道,生成3mol的氮气转移电子是30mol,当生成1mol氮气时,转移电子是10mol,故答案为:NO2-;Al(OH)3;10;
(3)因为含氮0.3mol的废水中的NO3-的物质的量为0.3mol,根据化学方程式,0.3mol的硝酸根离子消耗金属铝的物质的量为0.5mol,所以需要金属铝的质量是:0.5mol×27g/mol=13.5g,故答案为:13.5.
点评 本题是一道有关氧化还原知识的题目,要求学生熟记教材知识,并灵活应用.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:实验题
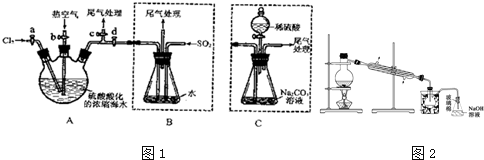
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
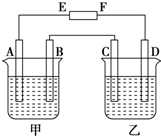 在图中,E和F分别为电源两极;甲烧杯中盛有100mL 0.2mol•L-1 AgNO3溶液,乙烧杯中盛有100mL 0.15mol•L-1 CuCl2溶液,A、B、C、D均为石墨电极,如果电解一段时间后,发现B极增重1.08g,则
在图中,E和F分别为电源两极;甲烧杯中盛有100mL 0.2mol•L-1 AgNO3溶液,乙烧杯中盛有100mL 0.15mol•L-1 CuCl2溶液,A、B、C、D均为石墨电极,如果电解一段时间后,发现B极增重1.08g,则查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Na2O2中加入足量水:2Na2O2+2H2O=4Na++4OH-+O2↑ | |
| B. | 向Ag(NH3)2NO3溶液中加入盐酸:Ag(NH3)2++2H+=Ag++2NH4+ | |
| C. | 向Al2(SO4)3溶液中加入过量氨水:Al3++3OH-=Al(OH)3↓ | |
| D. | 向Ca(HCO3)2溶液中加入澄清石灰水:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
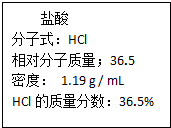 (I)表中①~⑥均是由Na、Mg、H、O、S、Cl等元素中的几种组成,根据物质的组成和性质将它们进行了分类.
(I)表中①~⑥均是由Na、Mg、H、O、S、Cl等元素中的几种组成,根据物质的组成和性质将它们进行了分类.| 物质类别 | 含氧强酸 | 碱 | 钠盐 |
| 化学式 | ①H2SO4②HClO4 | ③ ④Mg(OH)2 ④Mg(OH)2 | ⑤NaCl ⑥Na2SO3 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.025 mol | B. | 0.050 mol | C. | 0.10 mol | D. | 0.20 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
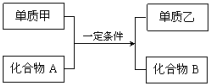 置换反应的通式可表示为:
置换反应的通式可表示为:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作和现象 | 结论 |
| A | 向Na2SiO3溶液中滴加几滴酚酞,然后逐滴加入稀盐酸至红色褪去,2min后,试管里出现凝胶 | 非金属性:Cl>Si |
| B | 取久置的Na2O2粉末,向其中滴加过量的盐酸后产生气体 | Na2O2没有变质 |
| C | 溴乙烷与NaOH溶液共热后,加入AgNO3溶液,未出现淡黄色沉淀 | 溴乙烷没有水解 |
| D | 向NaAlO2溶液中滴入NaHCO3溶液,产生白色沉淀 | AlO2-结合H+的能力比CO32-强 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com