
 喀麦隆的“杀人湖”(尼奥斯湖)曾于1986年使1800多名附近居民在一夜之间神秘死去.后经科学家考察发现,湖底有火山口,聚集了大量二氧化碳和二氧化硫等有毒气体并发现在200m深的湖底,每立方米湖水竟溶解8m3的有毒气体,目前科技人员已找到一种有效的办法将湖底的有毒气体抽出并加以处理.回答:
喀麦隆的“杀人湖”(尼奥斯湖)曾于1986年使1800多名附近居民在一夜之间神秘死去.后经科学家考察发现,湖底有火山口,聚集了大量二氧化碳和二氧化硫等有毒气体并发现在200m深的湖底,每立方米湖水竟溶解8m3的有毒气体,目前科技人员已找到一种有效的办法将湖底的有毒气体抽出并加以处理.回答:| m(I2) |
| 254 |
| m(I2) |
| 254×20×10-3 |
| W-127×10-3cV |
| 254×20×10-3 |
| W |
| 5..08 |
| cV |
| 40 |
| m(I2) |
| 254 |
| m(I2) |
| 254×20×10-3 |
| W-127×10-3cV |
| 254×20×10-3 |
| W |
| 5..08 |
| cV |
| 40 |
| W |
| 5..08 |
| cV |
| 40 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、非金属原子组成的化合物不可能是离子化合物 |
| B、ⅠA族元素的金属性一定比ⅡA族元素的金属性强 |
| C、同一主族元素组成的化合物一定是共价化合物 |
| D、NH4H中的所有原子的最外层都符合相应稀有气体原子电子层结构,1mol NH5中含有4NA个N-H键(NA表示阿伏加德罗常数的值) |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH3OH |
| B、(CH3)3COH |
| C、CH3CHOHCH3 |
| D、CH3CH2CH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:
 和
和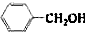 ,应选用
,应选用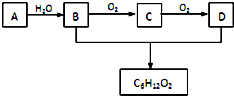 ,
,查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol金刚石中含有C-C键的数目为4NA |
| B、14克N2中含有的π键数目为NA |
| C、25℃,pH=13的NaOH溶液中含有OH-的数目为0.1NA |
| D、1L0.1mol/LAl2(SO4)3溶液中含有的Al3+总数为0.2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com