
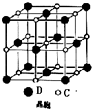
 A、B、C、D 是原子序数依次增大的短周期主族元素,A 的基态原子中电 子占据三个能级,且各个能级的电子数相等;B 的一种氧化物为红棕色气体;C 的原子半径 是短周期中最大的.D 的电负性是同周期中最大的;E 是第四周期第VIII族三种元素中原子序数 最小的元素.用元素符号回答下列问题:
A、B、C、D 是原子序数依次增大的短周期主族元素,A 的基态原子中电 子占据三个能级,且各个能级的电子数相等;B 的一种氧化物为红棕色气体;C 的原子半径 是短周期中最大的.D 的电负性是同周期中最大的;E 是第四周期第VIII族三种元素中原子序数 最小的元素.用元素符号回答下列问题:分析 A、B、C、D 是原子序数依次增大的短周期主族元素,A 的基态原子中电子占据三个能级,且各个能级的电子数相等,原子核外电子排布式为1s22s22p2,故A为碳元素;B 的一种氧化物为红棕色气体,该气体为NO2,B为氮元素;C 的原子半径是短周期中最大的,处于IA族,原子半径大于氮,故C为Na;D的原子序数大于Na,处于第三周期,D 的电负性是同周期中最大的,处于VIIA族,故D为Cl;E 是第四周期第VIII族三种元素中原子序数最小的元素,则E为Fe.
解答 解:A、B、C、D 是原子序数依次增大的短周期主族元素,A 的基态原子中电子占据三个能级,且各个能级的电子数相等,原子核外电子排布式为1s22s22p2,故A为碳元素;B 的一种氧化物为红棕色气体,该气体为NO2,B为氮元素;C 的原子半径是短周期中最大的,处于IA族,原子半径大于氮,故C为Na;D的原子序数大于Na,处于第三周期,D 的电负性是同周期中最大的,处于VIIA族,故D为Cl;E 是第四周期第VIII族三种元素中原子序数最小的元素,则E为Fe.
(1)Fe3+基态时 M 层电子的排布式为3s23p63d5,同周期自左而右电负性增大,金属性越强电负性越小,故电负性N>C>Na,
故答案为:3s23p63d5;N>C>Na;
(2)NCl3分子中N原子价层电子对数=3+$\frac{5-1×3}{2}$=4,则其 VSEPR 模型为四面体,
与N2互为等电子体微粒含有2个原子、价电子总数为10,该阴离子为CN-,
故答案为:四面体;CN-;
(3)晶体 Fe3C 熔点为 1837℃,性能坚硬而脆,符合离子晶体的性质,
以顶点C离子研究,与之距离最近的C离子处于面心,每个顶点为8个晶胞共用,每个面心为2个晶胞共用,故晶胞中距离 C 离子最近的 C 离子有$\frac{8×3}{2}$=12个,
故答案为:离子晶体;12;
(4)[Fe(CN)6]3-可以用于检验 Fe2+离子,它可由含 Fe2+的盐溶液与 NaCN 溶液混合后再与 Cl2反应制得,则制取[Fe(CN)6]3-的离子方程式为:2Fe2++12CN-+Cl2=2[Fe(CN)6]3-+2Cl-,
故答案为:2Fe2++12CN-+Cl2=2[Fe(CN)6]3-+2Cl-.
点评 本题是对物质结构与性质的考查,题目综合性较强,涉及核外电子排布、电负性、价层电子对互斥理论、等电子体、晶体结构、晶体类型与性质、配合物等,关键是根据核外电子排布规律推断元素.


科目:高中化学 来源: 题型:选择题
| A. | 钠和水反应:Na+H2O=Na++OH-+H2↑ | |
| B. | 二氧化硅和氢氧化钠溶液反应:SiO2+2OH-=SiO32-+H2O | |
| C. | 碳酸氢钡和稀硝酸反应:CO32-+2H+=CO2↑+H2O | |
| D. | 工业上电解饱和食盐水的反应:2Na++2Cl-$\frac{\underline{\;通电\;}}{\;}$2Na+Cl2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将 SO2 通入水中 | B. | 将 HCl 通入水中 | C. | 烧碱溶于水 | D. | 硫酸氢钾溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0 mol•L-1KNO3溶液:H+、Fe2+、SCN-、SO42- | |
| B. | $\frac{{c({H^+})}}{{c(O{H^-})}}={10^{-10}}$的溶液:K+、Ba2+、NO3-、Cl- | |
| C. | pH=0的溶液:Al3+、Cl-、SO42-、CO32- | |
| D. | c(ClO-)=1.0 mol•L-1的溶液:Na+、I-、S2-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 海水是盐的“故乡”,海水中含有各种盐类,其中70%为氯化钠,另外还含有氯化镁、硫酸镁等.
海水是盐的“故乡”,海水中含有各种盐类,其中70%为氯化钠,另外还含有氯化镁、硫酸镁等.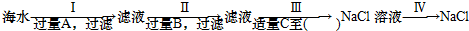
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 下表是元素周期表的一部分.表中所列的字母分别代表一种化学元素.
下表是元素周期表的一部分.表中所列的字母分别代表一种化学元素.| a | |||||||||||||||||
| b | c | d | e | f | |||||||||||||
| g | h | i | j | k | l | m | |||||||||||
| n | o | ||||||||||||||||
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 18gH2O含有的氢分子数目为NA | |
| B. | 标准状况下,22.4LCCl4含有的分子数目为NA | |
| C. | 1L 1mol•L-1K2SO4溶液中含有的钾离子数目为NA | |
| D. | 1mol Fe与足量的稀盐酸反应,失去的电子数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验设计或操作 | 观察或记录 | 结论或解释 |
| A | 向足量含淀粉的FeI2溶液中滴加2滴氯水 | 溶液变蓝 | 还原性:I->Fe2+ |
| B | 向10mL 0.2mol/L AgNO3溶液中滴入2滴0.1mol/L NaCl溶液,产生白色沉淀后,再滴加2滴0.1mol/LKI溶液 | 白色沉淀转化为黄色沉淀 | 证明在相同温度下的Ksp:AgCl>AgI |
| C | 浓硫酸滴入蔗糖中,并搅拌 | 得黑色蓬松的固体并有刺激性气味气体 | 该过程中浓硫酸仅体现吸水性和脱水性 |
| D | 把SO2通入橙色的溴水中 | 橙色褪去 | SO2具有漂白性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com