
| A. | 新制氯水中存在两种电离平衡 | |
| B. | 不同原子之间形成的共价键不一定是极性共价键 | |
| C. | 向久置于空气中的Na2SiO3、NaOH、CaCl2、漂白粉溶液里加足量盐酸,都能产生气体 | |
| D. | 将少量酸化的FeCl2溶液滴入过氧化氢溶液中,溶液变黄,并产生大量的气泡. |
分析 A.新制氯水中存在水的电离平衡、次氯酸的电离平衡;
B.不同种元素之间形成的共价键一定是极性共价键,不同的原子可能是同一元素;
C.硅酸钠和盐酸反应生成硅酸沉淀,和氢氧化钠溶液反应生成盐和水,和氯化钙不发生反应,漂白粉中加入盐酸发生归中反应生成氯气;
D.氯化亚铁在酸性溶液被过氧化氢氧化生成氯化铁溶液,氯化铁对过氧化氢起到催化剂作用,过氧化氢分解生成氧气和水.
解答 解:A.新制氯水中存在水的电离平衡H2O?H++OH-,次氯酸的电离平衡HClO?H++ClO-,新制氯水中存在两种电离平衡,故A正确;
B.不同种元素之间形成的共价键一定是极性共价键,不同的原子可能是同一元素,故B正确;
C.硅酸钠和盐酸反应生成硅酸沉淀,和氢氧化钠溶液反应生成盐和水,和氯化钙不发生反应,漂白粉中加入盐酸发生归中反应生成氯气,不能都产生气体,故C错误;
D.氯化亚铁在酸性溶液被过氧化氢氧化生成氯化铁溶液,2Fe2++H2O2+2H+=2Fe3++2H2O,2H2O2$\frac{\underline{\;FeCl_{3}\;}}{\;}$2H2O+O2↑,将少量酸化的FeCl2溶液滴入过氧化氢溶液中,溶液变黄,并产生大量的气泡,故D正确;
故选C.
点评 本题考查了物质性质、氧化还原反应、电离平衡等知识点,注意知识积累,题目较简单.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题

| A. | 电极a在装置中做正极 | |
| B. | 装置中膜A是阳离子交换膜 | |
| C. | 电极b的电极反应式是2NO3-+10e-+12H+═N2↑+6H2O | |
| D. | 若有机物表示为C4H8O2,每转移10mol电子,电极a上产生22.4LCO2(标准状况) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | A | B | C | D |
| 晶体名称 | 碘化钾 | 干冰 | 石墨 | 碘 |
| 晶体中 的粒子 | 阴、阳离子 | 分子 | 原子 | 分子 |
| 粒子间 的作用 | 离子键 | 分子间 作用力 | 共价键 | 分子间 作用力 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
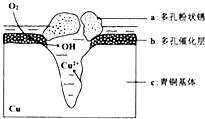 铜是一种重要的有色金属,近年来用途越来越广泛.请回答下列问题:
铜是一种重要的有色金属,近年来用途越来越广泛.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,写出反应X+Y→甲的热化学方程式:C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-110.6KJ/mol.
,写出反应X+Y→甲的热化学方程式:C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-110.6KJ/mol.
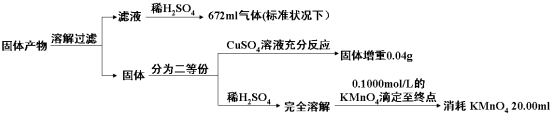
| 固体产物中的成分 | K2AB3 | … | ||
| 物质的量之比 | ||||
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 自然界中不存在游离态的硫 | |
| B. | 二氧化硫能使滴有酚酞的氢氧化钠溶液褪色,体现了其漂白性 | |
| C. | SO2既可以是含硫物质的氧化产物,又可以是含硫物质的还原产物 | |
| D. | 浓硫酸可用来干燥H2S、CO、Cl2等气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
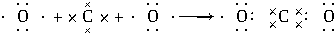 ,用电子式表示C、D两元素形成化学键的过程:
,用电子式表示C、D两元素形成化学键的过程: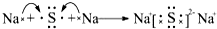 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

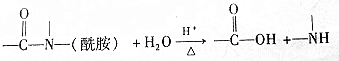
| A. | 该物质属于有机高分子 | B. | 不能发生酯化反应 | ||
| C. | 不能与氢气发生加成反应 | D. | 酸性条件下加热水解,有CO2生成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com