
分析 根据题意分析可知,将14.2g无水Na2SO4溶于180g水即可形成饱和溶液.
设当向该溶液中加入xgNa2SO4•10H2O恰好形成饱和溶液,这加入的xgNa2SO4•10H2O中含有的溶质Na2SO4的质量为x×$\frac{142}{322}$g,引入的水的质量为x×$\frac{180}{322}$g,故溶剂水的质量为(180+x×$\frac{180}{322}$)g,根据比例计算即可.
解答 解:根据题意分析可知,将14.2g无水Na2SO4溶于180g水即可形成饱和溶液.
设当向该溶液中加入xgNa2SO4•10H2O恰好形成饱和溶液,由于加入的xgNa2SO4•10H2O中含有的溶质Na2SO4的质量为x×$\frac{142}{322}$g=$\frac{142x}{322}$g,结晶水溶于水后也变为溶剂,即引入的水的质量为x×$\frac{180}{322}$g=$\frac{180x}{322}$g,故溶剂水的质量为(180+$\frac{180x}{322}$)g,则有:14.2g~180g
$\frac{142x}{322}$g~(180+$\frac{180x}{322}$)g
故有:$\frac{14.2g}{\frac{142x}{322}g}$=$\frac{180g}{(180+\frac{180x}{322})g}$
解得x=35.8g,
故答案为:35.8g.
点评 本题考查可饱和溶液的有关计算,应注意到当加入带结晶水的物质的时候,结晶水溶于水后也变为溶剂,难度不大.


科目:高中化学 来源: 题型:选择题
 用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )
用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )| 选项 | ①中物质 | ②中物质 | 预测中的现象 |
| A | 稀盐酸 | 碳酸钠、氢氧化钠混合溶液 | 立即产生气泡 |
| B | 浓硝酸 | 用砂纸打磨过的铝条 | 产生红棕色气体 |
| C | 氯化铝溶液 | 浓氢氧化钠溶液 | 产生大量白色沉淀 |
| D | 草酸溶液 | 高锰酸钾酸性溶液 | 溶液逐渐褪色 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室中所用少量氯气用如图装置制取,请回答下列问题:
实验室中所用少量氯气用如图装置制取,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
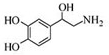
| A. | 每个去甲肾上腺素分子中含有3个酚羟基 | |
| B. | 每个去甲肾上腺素分子中含有1个手性碳原子 | |
| C. | 1mol去甲肾上腺素最多与2mol Br2发生取代反应 | |
| D. | 去甲肾上腺素既能与碳酸氢钠反应生成二氧化碳气体,又能与盐酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
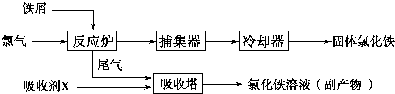
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com