
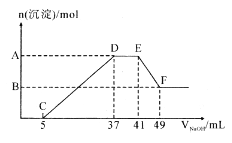
【题目】现有一定量的镁铝合金与100 mL 稀硝酸充分反应,在反应过程中无气体放出。在反应结束后的溶液中,逐滴加入1.00mol/ L NaOH溶液,加入NaOH 溶液的体积与产生沉淀的物质的量关系如图所示:
(1)合金中的铝与稀硝酸反应的化学方程式为_________;
(2)纵坐标上A 点数值是__________,B 点数值是_________;
(3)原HNO3 溶掖的物质的量浓度为_________。
【答案】 8Al+30HNO3=8Al(NO3)3+3NH4NO3+9H2O 0.012 0.004 0.45mol/L
【解析】在镁铝与稀硝酸反应后的混合溶液中滴加1.00mol/ L NaOH溶液,当沉淀量最多时,继续滴加NaOH溶液,最初沉淀量不减少,说明溶液中含有NH4+,发生的离子反应为NH4++OH-=NH3·H2O;
(1)合金中铝与稀硝酸反应生成硝酸铝和硝酸铵,发生反应的化学方程式为8Al+30HNO3=8Al(NO3)3+3NH4NO3+9H2O;
(2)EF阶段发生反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O,消耗NaOH的物质的量为(49mL-41mL)×10-3L/mol×1.00mol/ L=0.008mol,则生成Al(OH)3的物质的量为0.008mol,CD段发生离子反应生成Mg(OH)2 和Al(OH)3,共消耗NaOH的物质的量为(37mL-5mL)×10-3L/mol×1.00mol/ L=0.032mol,则生成Mg(OH)2 的物质的量为(0.032mol-0.008mol×3)÷2=0.004mol,故纵坐标A点生成沉淀的总物质的量为0.008mol+0.004mol=0.012mol,B点为Mg(OH)2 的物质的量为0.004mol;
(3)DE段消耗NaOH的物质的量为(41mL-37mL)×10-3L/mol×1.00mol/ L=0.004mol,则溶液中含有NH4NO3的物质的量为0.004mol,D点溶液为NaNO3和NH4NO3的混合溶液,NaNO3的物质的量等于D点加入NaOH的总物质的量,即为37mL×10-3L/mol×1.00mol/ L=0.037mol,根据原子守恒可知,原硝酸的物质的量为0.037mol+0.004mol×2=0.045mol,HNO3 溶掖的物质的量浓度为![]() =0.45mol/L。
=0.45mol/L。


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
【题目】下列关于碱金属及其化合物的叙述错误的是( )
A. 金属钠投入Ca(HCO3)2溶液,反应后有白色沉淀析出
B. 干粉灭火器能用于扑灭金属钠、钾的着火
C. 生理盐水的质量分数为0.9%,与人体的血液中含量相同,它的溶质是NaCl
D. 取用金属钠、钾时,所需实验用品有小刀、镊子、滤纸、玻璃片
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如图:则此有机物可发生的反应类型有( )
①取代 ②加成 ③氧化 ④酯化⑤中和.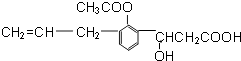
A.①②③④
B.②③④⑤
C.②③⑤
D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关下列能量转化的认识不正确的是( )
A.植物的光合作用使得太阳能转化为了化学能
B.人类使用照明设备是将电能转化为了光能
C.生物体内的化学变化过程在能量转化上比在体外发生的一些能量转化更为合理、有效
D.燃料燃烧时只是将化学能转化为了热能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有以下物质:①NaCl溶液 ②CH3COOH ③NH3 ④BaSO4 ⑤蔗糖 ⑥H2O,其中属于电解质的是( )
A. ②③④B. ②④⑥C. ③④⑤D. ①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中仅含有Na+、Mg2+、SO42-、Cl-四种离子(不考虑水电离出的H+和OH-),物质的量浓度之比为c(Na+)∶c(Mg2+)∶c(Cl-)=3∶5∶5。若Na+的物质的量浓度为3 mol·L-1,则SO42-的物质的量浓度为
A. 2 mol·L-1 B. 3 mol·L-1 C. 4 mol·L-1 D. 8 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原电池的离子方程式是 Zn + Cu2+ = Zn2+ + Cu,该原电池正确的组成是 ( )
正极 | 负极 | 电解质溶液 | |
A. | Cu | Zn | HCl |
B. | Zn | Cu | CuSO4 |
C. | Cu | Zn | CuSO4 |
D. | Cu | Zn | ZnCl2 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是由常见元素组成的一些单质及其化合物之间的转化关系图.各方框表示有关的一种反应物或生成物(部分物质已经略去).其中A、B、D在常温下均为无色无味的气体,C是能使湿润的红色石蕊试纸变蓝的气体,M是最常见的无色液体. 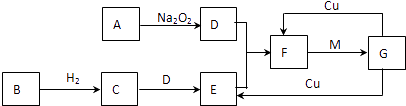
(1)写出C→E的化学方程式: .
(2)实验室常用加热两种固体混合物的方法制备物质C,其化学方程式为: , 干燥C常用(填写试剂名称).
(3)E物质遇到D物质时,会观察到现象,若用排水法收集F,则最终集气瓶中收集到的气体为(填写物质的化学式).
(4)写出F→G的离子方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表的形式多种多样,图是扇形元素周期表的一部分,对比中学常见元素周期表,分析其元素的填充规律,判断下列说法正确的是( ) 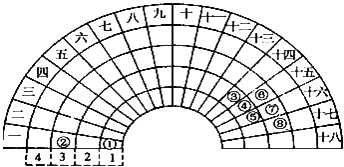
A.③元素形成的单质晶体均属于原子晶体
B.②、⑦、⑧对应的简单离子半径依次减小
C.②⑤形成的化合物阴阳离子个数比可能为1:1
D.④元素的气态氢化物易液化,是因为其分子间存在氢键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com