
| 族 周期 | IA | | 0 | |||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | | | | | | ② | ④ | |
| 3 | ⑤ | | ③ | | ⑧ | ⑥ | ⑦ | |
 作业辅导系列答案
作业辅导系列答案科目:高中化学 来源:不详 题型:填空题
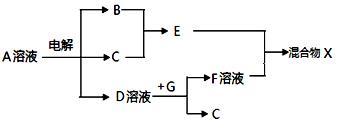
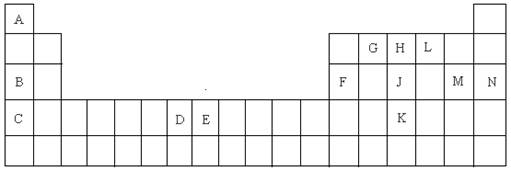
 数与中子数相等,能与B形成DB2、DB3常见化合物。根据以上条件,回答下列问题:
数与中子数相等,能与B形成DB2、DB3常见化合物。根据以上条件,回答下列问题:查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.同一元素不可能既表现金属性,又表现非金属性 |
| B.氯化氢溶于水能导电,但液态氯化氢不能导电 |
C.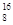 O、 O、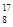 O和 O和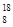 O互为同位素,均属于氧元素,且性质完全相同 O互为同位素,均属于氧元素,且性质完全相同 |
| D.导电性强的溶液里自由移动的离子数目一定比导电性弱的溶液里自由移动的离子数目多 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
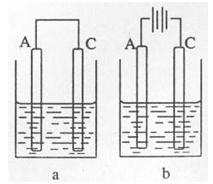
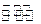 H2(g)+CO2(g)
H2(g)+CO2(g)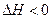 反应来制备合成氨的原料气,在1000℃下,用
反应来制备合成氨的原料气,在1000℃下,用 2NO(g),这是导致汽车尾气中含有NO的原因之一,该反应在不同温度下的平衡常数K如下表:
2NO(g),这是导致汽车尾气中含有NO的原因之一,该反应在不同温度下的平衡常数K如下表:| 温度 | 27℃ | 2000℃ |
| K值 | 3.84×10-31 | 0.1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A的氢化物 | B的氢化物 | M的氢化物 | X的氧化物 | Y的氢化物分子构型 | Z的最高价氧化物 |
| 含氢量最高的有机物 | 水溶液呈碱性 | 水溶液呈酸性 | 两性氧化物 | 正四面体 | 对应水化物为最强酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com