
| 操作和现象 | 结论 | |
| A | 向装有Fe(NO3)2溶液的试管中加入稀H2SO4,在管口观察到红棕色气体 | HNO3分解生成了NO2 |
| B | 向苯酚的浓溶液中加入溴水,无沉淀产生 | 苯酚与溴水不反应 |
| C | 向无水乙醇中加入浓H2SO4,加热至170℃,产生的气体通入酸性KMnO4溶液,紫红色褪去 | 使溶液褪色的气体只是乙烯 |
| D | 向饱和Na2CO3溶液中通入足量CO2,溶液变浑浊 | 析出了NaHCO3 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.酸性条件下,亚铁离子和硝酸根离子反应生成NO,NO易被氧气氧化生成红棕色气体二氧化氮;
B.向苯酚浓溶液中滴入溴水,生成三溴苯酚溶于苯酚;
C.乙醇能被酸性高锰酸钾溶液氧化;
D.碳酸氢钠溶解度小于碳酸钠.
解答 解:A.向Fe(NO3)2溶液中加入H2SO4,则会发生离子反应:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,产生的NO在管口生成NO2呈现红色,而不是HNO3分解产生NO2,故A错误;
B.向苯酚浓溶液中滴入溴水,生成三溴苯酚溶于苯酚,应选浓溴水,现象可观察到白色沉淀,故B错误;
C.乙醇和浓硫酸共热至170℃后发生消去反应生成乙烯,但乙醇易挥发,二者均可使高锰酸钾褪色,则该实验不能证明乙烯能使KMnO4溶液褪色,故C错误;
D.饱和Na2CO3溶液中通入CO2发生反应:Na2CO3+CO2+H2O=2NaHCO3,由于产生的碳酸氢钠溶解度小于碳酸钠,故会从过饱和溶液中析出,故D正确;
故选D.
点评 本题考查化学实验方案评价,为高考高频点,明确实验原理及物质性质是解本题关键,易错选项是A,注意酸性条件下硝酸根离子的强氧化性,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨基酸、多肽、蛋白质都具有两性 | |
| B. | 利用油脂在酸性条件下水解,可以产生甘油和肥皂 | |
| C. | 淀粉与纤维素分子式都为(C6H10O5)n,但结构不同,所以它们互为同分异构体 | |
| D. | 饱和Na2SO4、CuSO4溶液均可用于蛋白质的盐析 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当容器中X与Y的物质的量浓度之比满足1:2时,反应达到平衡 | |
| B. | 达到平衡后,反应速率3v正(Y)=2v逆(z) | |
| C. | 达到平衡时,X的转化率为25%,则平衡常数K值为$\frac{1}{16}$ | |
| D. | 达到平衡后,升高温度,X的体积分数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 s | B. | 2.5 s | C. | 10 s | D. | 5 s |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
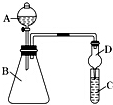 利用如图装置可验证酸的强弱规律.
利用如图装置可验证酸的强弱规律.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 操 作 | 实验现象 | 结 论 | |
| A | 某溶液中加入氯化钡、稀硝酸的 混合液 | 产生白色沉淀 | 该溶液中一定含有SO42-或SO32- |
| B | 取某溶液进行焰色反应 | 焰色呈黄色 | 该溶液一定是某钠盐的溶液 |
| C | 把湿润的碘化钾-淀粉试纸放入红棕色的气体中 | 试纸变蓝色 | 气体可能是NO2 |
| D | 取少量Fe(NO3)2试样加水溶解,加稀硫酸酸化,滴加KSCN溶液 | 溶液变为红色 | 该Fe(NO3)2试样已经变质 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com