
【题目】在80℃时,将0.40mol的N204气体充入2L已经抽空的固定容积的密闭容器中,发生如下反应:N2O42NO2 , 隔一段时间对该容器内的物质进行分析,得到如下数据:
时间(s) | 0 | 20 | 40 | 60 | 80 | 100 |
n(N2O4) | 0.40 | a | 0.20 | c | d | e |
n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
(1)计算20s一40s内用N2O4表示的平均反应速率为molL﹣1S﹣1;
(2)计算在80℃时该反应的平衡常数K=(请注明单位).
(3)反应进行至100s后将反应混合物的温度降低,混合气体的颜色(填“变浅”.“变深”或“不变”)
(4)要增大该反应的K值,可采取的措施有(填序号):
A.增大N2O4的起始浓度
B.向混合气体中通入NO2
C.使用高效催化剂
D.升高温度
(5)如图是80℃时容器中N2O4物质的量的变化曲线,请在该图中补画出该反应在60℃时N2O4物质的量的变化曲线. 
【答案】
(1)0.0020
(2)1.8mol?L﹣1
(3)变浅
(4)D
(5)解:当降低温度,化学反应速率减小,到达平衡所需时间增大,平衡向逆反应方向移动,所以到达新平衡时四氧化二氮的物质的量比第一次平衡时少,60℃曲线为.
故答案为:


【解析】解:(1)当20s时,生成二氧化氮0.24mol,则消耗四氧化二氮0.12mol,容器中还剩余0.40mol﹣0.12mol=0.28mol;v= ![]() =
= ![]() =0.0020mol/(L.s)
=0.0020mol/(L.s)
所以答案是:0.0020.(2)当到达80s时,二氧化氮的物质的量不再变化,所以反应达到平衡状态,二氧化氮的物质的量是0.60mol,则消耗四氧化二氮的物质的量是0.30mol,还剩余0.10mol,即d=e=0.10mol.
二氧化氮的平衡浓度= ![]() =0.30mol/L,四氧化二氮的平衡浓度=
=0.30mol/L,四氧化二氮的平衡浓度= ![]() =0.05mol/L
=0.05mol/L
K= ![]() =
= ![]() =1.8molL﹣1
=1.8molL﹣1
所以答案是:1.8molL﹣1 . (3)该反应的正反应是吸热反应,降低温度,平衡向逆反应方向移动,二氧化氮的含量减少,所以混合气体的颜色变浅.
所以答案是:变浅.(4)化学平衡常数只与温度有关,与其它任何物理量无关,故选D.
【考点精析】掌握化学平衡状态本质及特征和化学平衡的计算是解答本题的根本,需要知道化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效);反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:
【题目】如图可逆反应A+2B2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断( )
A.正反应是吸热反应
B.若A、B是气体,则D是液体或固体
C.改变物质浓度,平衡不会移动
D.A,B,C,D均为气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温、体积为2L的密闭容器中进行反应:2A(g) ![]() 3B(g)+C(g),若反应物在前20s由3mol降为1.8mol,则前20s的平均反应速率为( )
3B(g)+C(g),若反应物在前20s由3mol降为1.8mol,则前20s的平均反应速率为( )
A.v(B)=0.03 molL﹣1s﹣1
B.v(C)=0.06 molL﹣1s﹣1
C.v(C)=0.03 molL﹣1s﹣1
D.v(B)=0.045 molL﹣1s﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50mL 0.50molL﹣1盐酸与50mL 0.55molL﹣1 NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.
试回答下列问题:
(1)大小烧杯间填满碎纸条的作用是;
(2)大烧杯上如不盖硬纸板,求得的中和热数值将(填“偏大”、“偏小”或“无影响”),结合日常生活的实际该实验在进行效果更好;
(3)实验中改用60mL 0.50molL﹣1盐酸与50mL 0.55molL﹣1 NaOH溶液进行反应,与上述实验相比,所放出的热量(填“相等”、“不相等”),简述理由:;
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会;用50mL 0.5mo1L﹣1NaOH溶液进行上述实验,测得的中和热的数值会(填“偏大”、“偏小”或“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝热反应有广泛的用途,实验装置如下图所示。

(1)铝热反应是 __________________(填“吸热”或“放热”)反应,其能量变化可用下图中的 ___________________(填序号)表示。
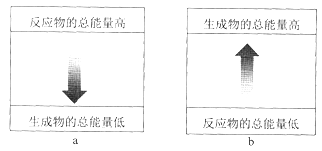
(2)该铝热反应的化学方程式是____________________________________。
(3)任写出铝热反应在实际生产中的一种用途____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为:S(s)+2KNO3(s)+3C(s)=K2S(s)+N2(g)+3CO2(g) △H=xkJ·mol-l
已知:①C(s)+O2(g)=CO2(g) △H=akJ·mol-l
②K2S(s)=S(s)+2K(s) △H=bkJ·mol-l
③2K(s)+N2(g)+3O2(g)=2KNO3(s) △H=ckJ·mol-l
下列说法正确的是
A. x>0 a<0
B. b<0 c<0
C. x=3a-b-c
D. 1mol 碳(s)在空气中不完全燃烧生成CO的焓变小于akJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应A (g)+xB(g)2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的如图所示.下列说法中正确是( ) 
A.8min前A的平均反应速率为0.08mol/(Ls)
B.30min时扩大容器的体积,40min时升高温度
C.反应方程式中的x=1,正反应为吸热反应
D.30min和54min的反应的平衡常数相等4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸是当今世界最重要的化工产品之一。
I.硫酸的各种制法。
(1)早在1000多年前,我国就已采用加热胆矾(CuSO4· 5H2O)或绿矾(FeSO4·7H2O)的方法制取硫酸。FeSO4受热分解的化学方程式:2 FeSO4![]() Fe2O3+SO2↑ +SO3↑。
Fe2O3+SO2↑ +SO3↑。
① 将FeSO4受热产生的气体通入如下图装置中,以检验产生的气体中是否含有SO3和SO2。 能说明SO2存在的实验现象是_________。
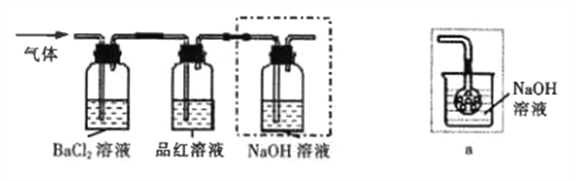
② 有同学提出虚线框内盛装NaOH溶液的装置可以换成上图右边的a装置,其中多孔玻璃球泡的作用是__________。
(2)目前工业上主要采用接触法制备硫酸,其中一步为:2SO2+O2![]() 2SO3。实验室模拟该过程常用下图装置进行实验。b装置中装有浓硫酸,写出b装置的作用__________(写出两点)。
2SO3。实验室模拟该过程常用下图装置进行实验。b装置中装有浓硫酸,写出b装置的作用__________(写出两点)。

Ⅱ.硫酸的性质。
(3)下图中甲试管内发生反应的化学方程式_________ ,该反应体现了浓硫酸的性质为______。

(4)当铜片与浓硫酸充分反应后,试管内并未出现蓝色溶液,而是看到白色固体,请写出检验白色固体的方法______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com