
| A.BaSO4比BaCO3溶解度小,所以,BaCO3可以转化为BaSO4 |
| B.BaCO3、BaSO4均不溶于水,所以都可以做钡餐试剂 |
| C.向Na2CO3溶液中加入BaCl2和Na2SO4,当两种沉淀共存时,c(SO42—)/ c(CO32—) =4.4×10-2 |
| D.常温下,BaCO3若要在Na2SO4溶液中开始转化为BaSO4,则Na2SO4的浓度必须不低于2.2×10-6 mol·L-1 |
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 化合物 | PbSO4 | PbCO3 | PbS |
| 溶解度/g | 1.03×10-4 | 1.81×10-7 | 1.84×10-14 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.c(Ca2+)、c(OH-)均增大 | B.c(Ca2+)、c(OH-)均保持不变 |
| C.c(Ca2+)、c(OH-)均减小 | D.c(OH-)增大、c(H+)减小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
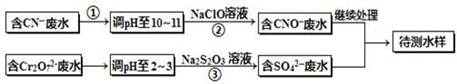
| A.x ="0.5" ,a =8 | B.x =0.5,a = 10 |
| C.x =" 1.5" ,a =8 | D.x =" 1.5" ,a = 10 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.具有吸附性 |
| B.溶解度与CuS、PbS、CdS等相同 |
| C.溶解度大于CuS、PbS、CdS |
| D.溶解度小于CuS、PbS、CdS |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com