
| A. | 此时甲烷与氧气的体积比为2:1 | |
| B. | 此时混合气体的平均相对分子质量约为26.7 | |
| C. | 此时混合气体中C、H、O原子的个数比为1:4:2 | |
| D. | 应在较为密闭的环境中使用瓦斯炉 |
分析 令甲烷与氧气的质量分别为1g、4g,根据n=$\frac{m}{M}$计算各自的物质的量.
A、相同条件下,体积之比等于物质的量之比,据此计算;
B、气体的平均相对分子质量$\overline{M}$=$\frac{{m}_{总}}{{n}_{总}}$;
C、根据甲烷的分子式为CH4,氧气的分子式为O2,并结合两者的物质的量之比来计算;
D、瓦斯的主要成分为甲烷,而甲烷不完全燃烧会生成CO.
解答 解:令甲烷与氧气的质量分别为1g、4g,则:甲烷的物质的量为$\frac{1}{16}$mol,氧气的物质的量为:$\frac{4g}{32g/mol}$=$\frac{1}{8}$mol.
A、相同条件下,体积之比等于物质的量之比,故此时甲烷与氧气的体积比为$\frac{1}{16}$mol:$\frac{1}{8}$mol=1:2,故A错误;
B、混合气体的平均摩尔质量$\overline{M}$=$\frac{{m}_{总}}{{n}_{总}}$=$\frac{5g}{\frac{1}{16}mol+\frac{1}{8}mol}$=26.7g/mol,而平均相对分子质量在数值上等于摩尔质量,故混合气体的平均相对分子质量为26.7,故B正确;
C、甲烷的物质的量为$\frac{1}{16}$mol,氧气的物质的量为$\frac{1}{8}$mol,故混合气体中含$\frac{1}{16}$molC原子,含$\frac{1}{4}$molH原子,含$\frac{1}{4}$mol氧原子,故C、H、O原子的个数之比为1:4:4,故C错误;
D、瓦斯的主要成分为甲烷,而甲烷不完全燃烧会生成CO,故若在比较密闭的环境中使用瓦斯炉,会导致甲烷的不完全燃烧,生成有毒的CO,故D错误.
故选B.
点评 考查常用化学计量的有关计算,比较基础,注意公式的掌握与灵活运用.


 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:解答题
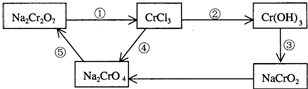
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol NH4Cl | B. | 0.1mol NH4NO3 | ||
| C. | 1.204×1023个CO(NH2)2 | D. | 0.2mol NH3•H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
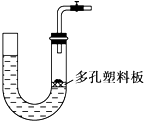
| A. | 大理石和稀硫酸制取二氧化碳 | B. | 锌粒和稀硫酸制氢气 | ||
| C. | 块状碳酸钠和稀盐酸制取二氧化碳 | D. | 氯酸钾和二氧化锰制取氧气 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| X | Y | Z | M | R | Q | |
| 原子半径/nm | 0.186 | 0.074 | 0.099 | 0.143 | ||
| 主要化合价 | -4,+4 | |||||
| 其他 | 阳离子 核外无电子 | 无机非金属材料的主角 | 焰色反 应呈黄色 |
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com