
| 物质 | 熔点 | 沸点 | 溶解度 |
| SeO2 | 340℃(315℃升华) | 684℃ | 易溶于水和乙醇 |
| TeO2 | 733℃(450℃升华) | 1260℃ | 微溶于水,不溶于乙醇 |
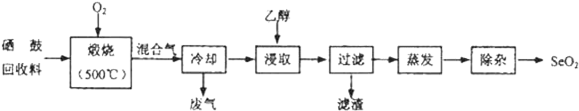
分析 硒鼓回收料含硒约97%,其余为约3%的碲和微量的氯,通入氧气煅烧过程中,回收料中的硒、碲被氧化成SeO2和TeO2,混合气体冷却得到物质加入乙醇浸取后过滤所得滤渣的主要成分TeO2 ,蒸发除去溶剂后,所得固体中仍含有少量TeO2杂质,利用升华分离除杂得到SeO2,
(1)Se与S是同族元素,比S多1个电子层,则Se核外含有4个电子层,最外层含有6个电子,据此判断其在周期表中的位置;根据非金属性强弱判断二者稳定性;
(2)煅烧后产物的主要成分为SeO2和TeO2,根据表中二者的性质解答;根据SeO2易升华分析;
(3)H2SeO3溶液与HI气体生成碘单质和Se沉淀;
(4)①H2SeO3是弱酸,水解呈碱性;
②A.c(SeO32-)带两个电荷;
BC.根据物料守恒解题;
D.根据质子守恒解题.
解答 解:(1)Se与S是同族元素,比S多1个电子层,则Se核外含有4个电子层,最外层含有6个电子,在元素周期表中位于第四周期、ⅥA族;同一主族中非金属性逐渐减弱,则非金属性S>Se,所以H2Se的热稳定性比H2S的热稳定性弱,
故答案为:第四周期ⅥA族;弱;
(2)煅烧后产物的主要成分为:和TeO2,由于TeO2微溶于水,不溶于乙醇,所以乙醇浸取后过滤所得滤渣的主要成分是TeO2;
由于SeO2易升华,则除去SeO2中少量Te02杂质,可通过升华的方法,故答案为:TeO2;升华;
(3)H2SeO3溶液与HI气体生成碘单质和Se沉淀,化学方程式:H2SeO3+4HI=Se↓+2I2+3H2O,故答案为:H2SeO3+4HI=Se↓+2I2+3H2O;
(4)①H2SeO3是弱酸,水解呈碱性,SeO32-+H2O?HSeO3-+OH-,故答案为:碱;SeO32-+H2O?HSeO3-+OH-;
②A.c(SeO32-)带两个电荷,应为c(Na+)+c(H+)=2c(SeO32-)+c(HSeO3-)+c(OH-),故A错误;
BC.钠原子个数为Se个数的二倍,c(Na+)=2c(SeO32-)+2c(HSeO3-)+2c(H2SeO3),故B错误、故C正确;
D.根据质子守恒可得:c(OH-)=c(HCO3-)+2c(H2CO3)+c(H+),故D错误.
故答案为:C.
点评 本题考查了物质制备方案的设计,题目难度中等,明确制备流程、发生反应原理为解答关键,涉及元素周期表应用、物质分离与除杂、化学方程式书写以及溶液中的离子浓度关系等知识,试题培养了学生的分析能力及化学实验能力.


 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:高中化学 来源: 题型:选择题
| A. | 5.1 g | B. | 10.2 g | C. | 13.6 g | D. | 15.3 g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 沸点/℃ | 熔点/℃ |
| S | 445 | 113 |
| CS2 | 47 | -109 |
| CCl4 | 77 | -23 |
| S2Cl2 | 137 | -77 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
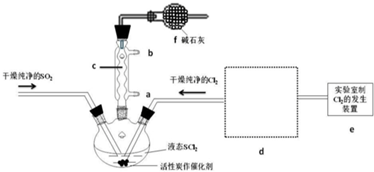
| 方案 | 甲 | 乙 | 丙 | 丁 |
| 发生装置 | 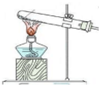 |  | 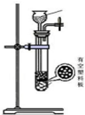 | 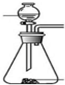 |
| 所选试剂 | NaHSO3固体 | 18.4mol/LH2SO4+Cu | 4mol/LHNO3+Na2SO3 | 70%H2SO4+K2SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
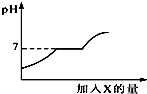 现有盐酸和CaCl2的混合溶液,向其中逐滴加入过量某物质X,溶液的pH随滴入X的量的变化关系如图所示.则X是( )
现有盐酸和CaCl2的混合溶液,向其中逐滴加入过量某物质X,溶液的pH随滴入X的量的变化关系如图所示.则X是( )| A. | 水 | B. | 澄清石灰水 | C. | 纯碱溶液 | D. | 稀盐酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com