
①m+6、②m+4、③m-4、④m-2、⑤m+8、⑥m+14、⑦m-12
A.②③⑥
B.①②③④
C.①②⑥⑦
D.①②③④⑤⑥⑦
 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
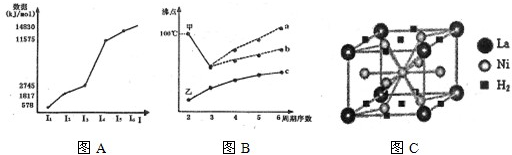
(12分)元素周期表中第四周期元素由于受3d电子的影响,性质的递变规律与短周期元素略有不同。
⑴第四周期过渡元素的明显特征是形成多种多样的配合物。
①CO可以和很多过渡金属形成配合物,如羰基铁[Fe(CO)5]、羰基镍[Ni(CO)4]。CO分子中C原子上有一对孤对电子,C、O原子都符合8电子稳定结构,CO的结构式为 ,与CO互为等电子体的离子为 (填化学式)。
②金属镍粉在CO气流中轻微加热,生成液态Ni(CO)4分子。423K时,Ni(CO)4分解为Ni和CO,从而制得高纯度的Ni粉。试推测Ni(CO)4易溶于下列 。
a.水 b.四氯化碳 c.苯 d.硫酸镍溶液
⑵第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的。镓的基态原子的电子排布式是 ,Ga的第一电离能却明显低于Zn,原因是 。
⑶用价层电子对互斥理论预测H2Se和BBr3的立体结构,两个结论都正确的是 。
a.直线形;三角锥形 b.V形;三角锥形
c.直线形;平面三角形 d.V形;平面三角形
⑷Fe、Co、Ni、Cu等金属能形成配合物与这些金属原子的电子层结构有关。
①Fe(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体属于 (填晶体类型)。
②CuSO4·5H2O(胆矾)中含有水合铜离子因而呈蓝色,写出胆矾晶体中水合铜离子的结构简式(必须将配位键表示出来) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
(13分) A、B、C均为短周期元素,可形成A2C和BC2两种化合物。A、B、C的原子序数依次递增,A原子的K层的电子数目只有一个,B位于A的下一周期,它的最外能层电子数比K层多2个,而C原子核外的最外能层电子数比次外层电子数少2个。
(1)它们的元素符号分别为:A ;B ;C ;
(2)BC2是由 键组成的 (填“极性”或“非极性”)分子。
(3)画出C原子的轨道表示式 。
(4)A2C和BC2的空间构形分别是 和 。
查看答案和解析>>
科目:高中化学 来源:2014届福建省高二下学期第二次月考化学试卷(解析版) 题型:填空题
均由两种短周期元素组成的A、B、C、D化合物分子,都含有18个电子,它们分子中所含原子的数目依次为2、3、4、6。A和C分子中的原子个数比为1∶1,B和D分子中的原子个数比为1∶2。D可作为火箭推进剂的燃料。
请回答下列问题:
(1)A、B、C、D分子中相对原子质量较大的四种元素第一电离能由大到小排列的顺序为
(用元素符号回答)。
(2)A与HF相比,其熔、沸点较低,原因是 。
(3)B分子的空间构型为 形,该分子属于 分子(填“极性”或“非极性”) 。
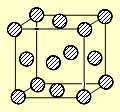
(4)C为一种绿色氧化剂,有广泛应用。请写出Cu、稀H2SO4与C反应制备硫酸铜的离子方程式 ,该反应中反应物Cu的基态原子电子排布式为 。铜晶体中铜原子的堆积方式为面心立方堆积,下图是铜晶体一个晶胞的示意图,则晶胞中含 个铜原子。
(5)D分子中心原子的杂化方式是 ,由该原子组成的单质分子中包含
个π键,与该单质分子互为等电子体的常见分子的分子式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com