
| t�� | 700 | 800 | 850 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
| c(CO)?c(H 2O) |
| c(CO 2)?c(H 2) |
| c(CO)?c(H 2O) |
| c(CO 2)?c(H 2) |
| 2 |
| 2 |
| 1 |
| 2 |
| 0.4 |
| 5 |
| y��y |
| (2-y)��(1-y) |
| 2 |
| 3 |
| ||
| 2 |
| 1 |
| 3 |
| 1 |
| 3 |


 ͬ��ѧ��һ�ζ���ϵ�д�
ͬ��ѧ��һ�ζ���ϵ�д� �����ܾ�ϵ�д�
�����ܾ�ϵ�д� ���ƿ�����ϵ�д�
���ƿ�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
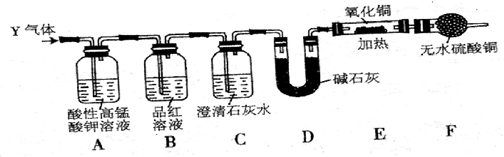
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
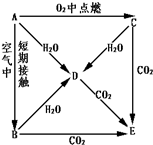 A��B��C��D��E�������ʶ���1��18��Ԫ���е�ijһԪ�أ����ǰ���ͼ��ʾ��ϵ�ת������֪A����Ϊ���ʣ�C����ɫ�ʻ�ɫ��
A��B��C��D��E�������ʶ���1��18��Ԫ���е�ijһԪ�أ����ǰ���ͼ��ʾ��ϵ�ת������֪A����Ϊ���ʣ�C����ɫ�ʻ�ɫ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����c��H+��=10-10mol/L����Һ�� Al3+��NH4+��Cl-��NO3- |
| B��ʹ���ȳʺ�ɫ����Һ Fe3+��Na+��SO42-��NO3- |
| C��ˮ���������c��H+��=10-12mol/L����Һ K+��HCO3-��Cl-��ClO- |
| D����Al3+��CO32-��Na+��AlO2-����Һ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com