
【题目】[化学——选修3:物质结构与性质](15分)
“摩尔盐”是分析化学中的重要试剂,化学式为(NH4)2Fe(SO4)2·6H2O。“摩尔盐”在一定条件下分解的方程式为:4[(NH4)2Fe(SO4)2·6H2O]![]() 2Fe2O3+3SO3+5SO2↑+N2↑+6NH3↑+31H2O。回答下列问题:
2Fe2O3+3SO3+5SO2↑+N2↑+6NH3↑+31H2O。回答下列问题:
(1)铁元素在元素周期表中的位置为 ,其价层电子排布图为 。
(2)组成“摩尔盐”的非金属元素中第一电离能最大的元素为 。“摩尔盐”的分解产物中属于非极性分子的化合物是____。
(3)NH3的沸点比N2O的沸点 (填“高”或“低”),其主要原因是 。
(4)K3[Fe(CN)6]常用于检验Fe2+,K3[Fe(CN)6]中除了离子键以外还存在的化学键为_______ ____,与CN—互为等电子体的单质的分子式为___ _。HCN分子中σ键和π键的个数之比为 。
(5)FeO晶胞结构如下图所示,FeO晶体中Fe2+配位数为__________,若该晶胞边长为acm,则该晶胞密度为__________。

【答案】
(1)第四周期第Ⅷ族(2分) ![]() (2分)
(2分)
(2)N(1分) SO3(1分)
(3)高(1分) NH3分子间存在氢键(1分)
(4)共价键和配位键(2分) N2(1分) 1∶1(1分)
(5)6(1分) ![]() g/cm3(2分)
g/cm3(2分)
【解析】
试题分析:
(1)铁的原子序数是26,位于第四周期第Ⅷ族;根据核外电子排布规律可知铁的价层电子排布图为![]() 。
。
(2)组成“摩尔盐”的非金属元素有H、N、O、S,其中第一电离能最大的元素为N。三氧化硫是平面三角形结构,属于非极性分子。
(3)NH3分子间存在氢键,因此NH3的沸点比N2O的沸点高。
(4)K3 [Fe(CN)6 ]晶体中,由于Fe3+有空轨道,能接受孤对电子,CN-能提供孤对电子,所以Fe3+与CN-之间的化学键类型为配位键,另外C与N之间还有共价键;等电子体是原子数相等,价电子数数也相等的离子或分子,与CN—互为等电子体的单质的分子式为 N2;
(5)以亚铁离子为中心,沿X、Y、Z三轴进行切割,可知亚铁离子配位数为![]() =6;由图可知,该晶胞中亚铁离子个数=8×
=6;由图可知,该晶胞中亚铁离子个数=8×![]() +6×
+6×![]() =4,氧离子个数=1+12×
=4,氧离子个数=1+12×![]() =4,设晶胞边长为acm,晶胞体积为a3cm3,则ρ=
=4,设晶胞边长为acm,晶胞体积为a3cm3,则ρ=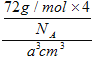 =
=![]() g/cm3。
g/cm3。


科目:高中化学 来源: 题型:
【题目】A、B、C、D四种化合物,有的是药物,有的是香料。它们的结构简式如下所示:
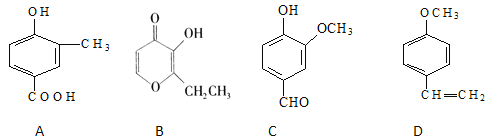
(1)化合物A的分子式是____________;C中含有的官能团的名称是_____________;
(2)A、B、C、D四种化合物中互为同分异构体的是(填序号)__________________;
(3)化合物B的核磁共振氢谱中出现_______组峰;
(4)1mol D最多能与_____________mol的氢气发生加成反应;
(5)A与乙二醇以物质的量2:1反应生成一种酯,请写出该反应的化学方程式(注明反应条件):_______________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方法中,可以使0.10 mol·L-1 CH3COOH溶液中CH3COOH电离程度增大的是
A. 加入少量冰醋酸 B. 加水稀释
C. 加入少量氯化钠固体 D. 加入少量醋酸钠固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)甲醇是重要的化工原料,又可作为燃料。工业上利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g)![]() CH3OH(g) ΔH1
CH3OH(g) ΔH1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-58 kJ/mol
CH3OH(g)+H2O(g) ΔH=-58 kJ/mol
③CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH=+41 kJ/mol
CO(g)+H2O(g) ΔH=+41 kJ/mol
回答下列问题:
(1)已知反应①中相关的化学键键能数据如下:
化学键 | H-H | C-O | C | H-O | C-H |
E/(kJ·mol-1) | 436 | 343 | 1076 | 465 | x |
则x=_________。
(2)若将lmol CO2和2mol H2充入容积为2L的恒容密闭容器中,在两种不同温度下发生反应②。测得CH3OH的物质的量随时间的变化如图所示。

①曲线I、Ⅱ对应的平衡常数大小关系为KI_____KⅡ(填“>”或“=”或“<”);
②一定温度下,能判断该反应达到化学平衡状态的是_____。
a.容器中压强不变 b.甲醇和水蒸气的体积比保持不变
c.v正(H2)=3v逆(CH3OH) d.2个C=O断裂的同时有6个H—H断裂
③若5min后反应达到平衡状态,H2的转化率为90%,则用CO2表示的平均反应速率为_________,该温度下的平衡常数为_______;若容器容积不变,下列措施可增加甲醇产率的是________。
a.缩小反应容器的容积 b.使用合适的催化剂
c.充入He d.按原比例再充入CO2和H2
(3)以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池。以此电池作电源,在实验室中模拟铝制品表面“钝化”处理过程(装置如图所示)。其中物质b是_____ ,阳极电极反应为____ 。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为提纯下列物质(括号内的物质是杂质),所选用的除杂试剂和分离方法都正确的是
选项 | 混合物 | 除杂试剂 | 分离方法 |
A | 己烷(己烯) | 溴的CCl4溶液 | 分液 |
B | 溴乙烷(乙醇) | 水 | 分液 |
C | 淀粉溶液(NaCl) | 水 | 过滤 |
D | 皂化液(甘油) | NaCl | 盐析,分液 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活密切相关,下列有关说法正确的是
A. 淀粉与纤维素互为同分异构体
B. 煤的气化、液化与石油的裂化、裂解均为化学变化
C. 被称为“黑金”的新型纳米材料石墨烯属于有机化合物
D. 糖类、油脂和蛋白质都属于营养物质,都能发生水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的方程式不正确的是 ( )
A. 制Cl2时用排饱和氯化钠溶液收集气体:H2O + Cl2 ![]() Cl-+H+ + HClO
Cl-+H+ + HClO
B. SO2的水溶液显酸性:SO2+H2O ![]() H2SO3
H2SO3![]() 2H++ SO32-
2H++ SO32-
C. 常温下,0.1mol/L醋酸溶液pH≈3:CH3COOH![]() CH3COO-+ H+
CH3COO-+ H+
D. Mg(OH)2固体在溶液中存在平衡:Mg(OH)2(s)![]() Mg2+(aq)+2OH-(aq),该固体可溶于NH4Cl溶液
Mg2+(aq)+2OH-(aq),该固体可溶于NH4Cl溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com