
下列说法正确的是 ( )
A.用酸性高锰酸钾即可鉴别苯酚溶液,2,4-己二烯和甲苯
B. 按系统命名法化合物  的名称为:2,5,6-三甲基-3-乙基庚烷
的名称为:2,5,6-三甲基-3-乙基庚烷
C. 新型解热镇痛抗炎药贝诺酯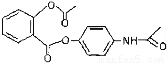 在酸性条件下完全水解可以得到3种有机物
在酸性条件下完全水解可以得到3种有机物
D.β—月桂烯的结构如图 ,一分子该物质与两分子溴发生加成反应的产物(只考虑位置异构)理论上最多有3种
,一分子该物质与两分子溴发生加成反应的产物(只考虑位置异构)理论上最多有3种
C
【解析】
试题分析:A、苯酚溶液,2,4-己二烯和甲苯均能被酸性高锰酸钾溶液氧化,不能鉴别,A不正确;B、按系统命名法化合物  的名称为:2,3,6-三甲基-5-乙基庚烷,B不正确;C、新型解热镇痛抗炎药贝诺酯
的名称为:2,3,6-三甲基-5-乙基庚烷,B不正确;C、新型解热镇痛抗炎药贝诺酯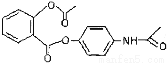 在酸性条件下完全水解可以得到3种有机物,即邻羟基苯甲酸、乙酸、对羟基苯胺,结构简式分别是
在酸性条件下完全水解可以得到3种有机物,即邻羟基苯甲酸、乙酸、对羟基苯胺,结构简式分别是 、CH3COOH、
、CH3COOH、 ,C正确;因分子存在三种不同的碳碳双键,如图所示
,C正确;因分子存在三种不同的碳碳双键,如图所示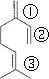 ;1分子物质与2分子Br2加成时,可以在①②的位置上发生加成,也可以在①③位置上发生加成或在②③位置上发生加成,还可以1分子Br2在①②发生1,4加成反应,另1分子Br2在③上加成,故所得产物共有四种,D不正确,答案选C。
;1分子物质与2分子Br2加成时,可以在①②的位置上发生加成,也可以在①③位置上发生加成或在②③位置上发生加成,还可以1分子Br2在①②发生1,4加成反应,另1分子Br2在③上加成,故所得产物共有四种,D不正确,答案选C。
考点:考查有机物鉴别、命名、结构与性质以及同分异构体判断


 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源:2013-2014浙江省高一下学期期末考试化学试卷(解析版) 题型:选择题
某Na2CO3、NaAlO2的混合溶液中逐滴加入1mol·L-1的盐酸,测得溶液中的CO32-、HCO3-、AlO2-、Al3+的物质的量与加入盐酸溶液的体积变化关系如图所示。请根据图像推断,下列说法中不正确的是(已知HCO3-与AlO2-在溶液中不能共存)

A.M点时生成的CO2为0 mol
B.原混合溶液中的CO32-与AlO2-的物质的量之比为1:2
C.V1:V2=1:4
D.a段表示的离子方程式为:AlO2- +H+ + H2O=Al(OH)3↓
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江省宁波市高一下学期期末考试化学试卷(解析版) 题型:填空题
催化剂是化工技术的核心,绝大多数的化工生产均需采用催化工艺。
(1)人们常用催化剂来选择反应进行的方向。下左图所示为一定条件下1mol CH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化图[反应物O2(g)和生成物H2O(g)略去]。

①在有催化剂作用下,CH3OH与O2 反应主要生成 (填“CO、CO2、HCHO”);
②2HCHO(g)+O2(g)=2CO(g)+2H2O(g) △H= 。
(2)一种以铜作催化剂脱硫有如下两个过程:
①在铜的作用下完成工业尾气中SO2的部分催化氧化,所发生反应为:
2SO2+2n Cu+(n+1)O2+(2-2 n) H2O=2n CuSO4+(2-2n) H2SO4
从环境保护的角度看,催化脱硫的意义为 ;每吸收标准状况下11.2L SO2,被SO2还原的O2的质量为 g。
②利用下图所示电化学装置吸收另一部分SO2,并完成Cu的再生。写出装置内所发生反应的离子方程式 。

查看答案和解析>>
科目:高中化学 来源:2013-2014浙江省宁波市高一下学期期末考试化学试卷(解析版) 题型:选择题
下列关于教材中的各项说法错误的一项是( )
A.在化学反应中,反应物转化为生成物的同时,必然发生能量的变化
B.氮肥包括铵态氮肥、硝态氮肥和尿素
C.在书写热化学方程式时应标明反应物及生成物的状态,无需标明反应温度和压强
D.医疗上用的石膏绷带是利用熟石膏与水混合成糊状后很快凝固的性质
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江省台州市路桥区高考理综化学模拟试卷二试卷(解析版) 题型:实验题
三氯化六氨合钴(Ⅲ)是一种重要的化工产品, 实验中采用H2O2作氧化剂,在大量氨和氯化铵存在下,选择活性炭作为催化剂将Co(Ⅱ)氧化为Co(Ⅲ),来制备三氯化六氨合钴(Ⅲ)配合物,反应式为:2CoCl2·6H2O + 10NH3 + 2NH4Cl + H2O2 活性炭2[Co(NH3)6]Cl3 +14H2O
已知:① 钴(Ⅱ)与氯化铵和氨水作用,经氧化后一般可生成三种产物:紫红色的二氯化一氯五氨合钴[Co(NH3)5 Cl]Cl2晶体、砖红色的三氯化五氨一水合钴[Co(NH3)5 H2O]Cl3晶体、橙黄色的三氯化六氨合钴[Co(NH3)6]Cl3晶体,控制不同的条件可得不同的产物(如温度不同产物也不同)。293K时,[Co(NH3)6]Cl3在水中的溶解度为0.26mol/L
②CoCl2、[Co(NH3)6]Cl3、[Co(NH3)5 Cl]Cl2在水中能完全电离
③制备三氯化六氨合钴(Ⅲ)粗产品的流程如下:

④三氯化六氨合钴(Ⅲ)粗产品的提纯流程如下:
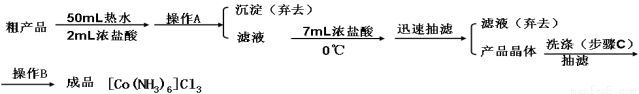
⑤制备过程中可能用到的部分装置如下:


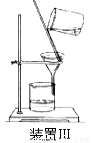
请回答下列问题:
(1)操作B的名称是 ,操作A后所弃去的沉淀中一定有 。
(2)CoCl2在没有铵盐存在的情况下,遇氨水生成蓝色沉淀,该反应的离子方程式为 。原料NH4Cl的主要作用有:① ;②提供NH3。
(3)冷却至10℃后,步骤B中逐滴加入H2O2溶液的目的:① ;②使反应温和进行。
(4)操作A的名称为 ,进行该操作的装置是 (填序号)。
A.装置Ⅰ B.装置Ⅱ C.装置Ⅲ
若操作过程中,发现漏斗尖嘴处有少量晶体析出,处理方法是 。
装置Ⅱ中仪器A、B、C、D的名称分别是 、 、 、 。
(5)步骤C进行洗涤时要用到两种试剂,应该先用_____(填序号,下同)洗涤,后用 洗涤。
A. 饱和氯化钠溶液 B. 无水乙醇 C. 浓盐酸
(6)你认为本实验提高产率的关键步骤有哪些? 。
(7)与[Co(NH3)6]Cl3类似的产品还有[Co(NH3)5Cl]Cl2,请简述验证某晶体是[Co(NH3)6]Cl3 还是
[Co(NH3)5Cl]Cl2的实验方案: 。
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江省台州市路桥区高考理综化学模拟试卷一试卷(解析版) 题型:推断题
(15分)某有机物X(C13H14O8)分子中含有多种官能团,其结构为(其中I、II为未知部分的结构):

为推测X的分子结构,现进行如图所示的转化。

已知:①E分子中检测到18O原子,向E的水溶液中滴入FeCl3溶液显紫色,E的核磁共振氢谱中有4组峰,且峰面积之比为1︰2︰2︰1,E与NaHCO3反应有CO2产生;②G的分子式为C2H2O4。请回答下列问题:
(1)E分子所含官能团的名称是 _________________ ;X溶液遇FeCl3溶液不显紫色,则X的结
构简式为 __________________________________ 。
(2)写出B与G反应生成M(分子内含有六元环)的化学方程式:_____________________ 。
(3)F有特殊愉快的酸味,可作为食品饮料的添加剂;F的聚合物具有良好的生物相容性,可作为手术缝合线等材料广泛应用于生物医药和生物材料领域。由B经过下列途径可合成F:

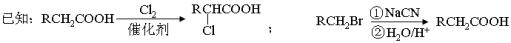
①N→T的反应类型是 __________ ,N的结构简式是 _____________ 。
②写出T→F的第一步反应的化学方程式: ___________________________________ 。
(4)E有多种同分异构体,写出符合下列条件的所有同分异构体的结构简式:_____________ 。
①属于芳香族化合物;②能发生银镜反应;③苯环上的一氯代物只有2种
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江省台州市路桥区高考理综化学模拟试卷一试卷(解析版) 题型:选择题
下图甲是CO2电催化还原为碳氢化合物的工作原理示意图,用一种钾盐水溶液作电解液;图乙是用H2还原CO2制备甲醇的工作原理示意图,硫酸为电解质溶液。下列说法不正确的是


A.甲中铜片作阴极,K+向铜片电极移动
B.乙中正极发生的电极反应为CO2+6e-+6H+=CH3OH+H2O
C.甲中若CxHy为C2H4,则生成1 mol C2H4的同时生成2 molO2
D.乙中H2SO4的作用是增强溶液的导电性
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江省下学期第二次统练高二化学试卷(解析版) 题型:选择题
下列说法正确的是
A.第一电离能越小的元素其单质金属活泼性一定越大
B.电负性越小的元素金属性一定越强
C.元素电负性相差小于1.7的元素之间形成的化学键一定为共价键
D.制造光电材料的元素主要从IA族中寻找其主要原因是IA的第一电离能比较低
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江省五校高三第二次联考理综化学试卷(解析版) 题型:填空题
(15分)已知2A(g)+B(g)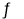 2C(g),?H=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2 mol A和1 mol B,在500 ℃时充分反应达平衡后C的浓度为ω mol/L,放出热量为b kJ。
2C(g),?H=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2 mol A和1 mol B,在500 ℃时充分反应达平衡后C的浓度为ω mol/L,放出热量为b kJ。
⑴比较a b(填“>”“=”或“<”)。
⑵下表为不同温度下该反应的平衡常数。由此可推知,表中T1 T2(填“>”、“=”或“<”)。
T/K | T1 | T2 | T3 |
K | 1.00×107 | 2.45×105 | 1.88×103 |
若在原来的容器中,只加入2 mol C,500 ℃时充分反应达平衡后,吸收热量为c kJ,C的浓度 (填“>”“=”或“<”)ωmol/L,a、b、c之间满足何种关系 (用代数式表示)。
⑶ 在相同条件下要想得到2a kJ热量,加入各物质的物质的量可能是 。
A. 4 mol A和2 mol BB. 4 mol A、2 mol B和2 mol C
C. 4 mol A和4 mol BD. 6 mol A和4 mol B
⑷为使该反应的反应速率增大,且平衡向正反应方向移动的是 。
A. 及时分离出C气体B. 适当升高温度
C. 增大B的浓度D. 选择高效催化剂
⑸ 若将上述容器改为恒压容器(反应前体积相同),起始时加入2 mol A和1 mol B,500 ℃时充分反应达平衡后,放出热量为d kJ,则d b(填“>”、“=”或“<”),理由是_ 。
⑹ 在一定温度下,向一个容积可变的容器中,通入3 mol A和2 mol B及固体催化剂,使之反应,平衡时容器内气体物质的量为起始时的90%。保持同一反应温度,在相同容器中,将起始物质的量改为4 mol A、3 mol B和2 mol C,则平衡时A的百分含量 (填“不变”、“变大”、“变小”或“无法确定”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com