
| A. | NaHCO3与石灰水反应,当n(NaHCO3):n[Ca(OH)2]=3:1时,溶液中无HCO${\;}_{3}^{-}$ | |
| B. | CO2通入石灰水中,当n(CO2):n[Ca(OH)2]=1:1时,能得到澄清溶液 | |
| C. | AlCl3溶液与烧碱溶液反应,当n(OH-):n(Al3+)=5:1时,铝元素以AlO${\;}_{2}^{-}$形式存在 | |
| D. | Fe与稀硝酸反应,当n(Fe):n(HNO3)=1:1时,溶液中只有Fe3+存在 |
分析 A、2NaHCO3+Ca(OH)2=CaCO3↓+Na2CO3+2H2O,当n(NaHCO3):n[Ca(OH)2]=2:1时,无碳酸氢根离子;
B、当n(CO2):n[Ca(OH)2]=1:1时,发生反应CO2+Ca(OH)2=CaCO3↓+H2O↓;
C、n(OH-):n(Al3+)=4:1时,发生反应为:4OH-+Al3+=AlO2-+2H2O,由此分析解答;
D、Fe与稀硝酸反应,Fe不过量生成Fe3+,4H++NO3-+Fe═Fe3++NO↑+2H2O,Fe过量生成Fe2+,8H++2NO3-+3Fe═3Fe2++2NO↑+4H2O,不能用同一个离子方程式来表示,而n(Fe):n(HNO3)=1:1时,铁过量.
解答 解:A、2NaHCO3+Ca(OH)2=CaCO3↓+Na2CO3+2H2O,当n(NaHCO3):n[Ca(OH)2]=2:1时,所以当n(NaHCO3):n[Ca(OH)2]=3:1时,溶液中碳酸氢根离子过量,故A错误;
B、当n(CO2):n[Ca(OH)2]=1:1时,发生反应CO2+Ca(OH)2=CaCO3↓+H2O↓,有沉淀生成,所以得不到澄清溶液,故B错误;
C、n(OH-):n(Al3+)=4:1时,发生反应为:4OH-+Al3+=AlO2-+2H2O,所以当n(OH-):n(Al3+)=5:1时,铝元素以AlO2-形式存在,故C正确;
D、Fe与稀硝酸反应,Fe不过量生成Fe3+,4H++NO3-+Fe═Fe3++NO↑+2H2O,Fe过量生成Fe2+,8H++2NO3-+3Fe═3Fe2++2NO↑+4H2O,不能用同一个离子方程式来表示,而n(Fe):n(HNO3)=1:1时,铁过量,所以溶液中只有亚铁离子,故D错误;
故选C.
点评 本题考查与量有关的离子反应,明确反应的产物是解答的关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
 2014年世界杯足球赛在巴西举行,2016年巴西又将举办31届奥运会.奥运五环代表着全世界五大洲的人民团结在一起.下列各项中的物质,能满足如图中阴影部分关系的是( )
2014年世界杯足球赛在巴西举行,2016年巴西又将举办31届奥运会.奥运五环代表着全世界五大洲的人民团结在一起.下列各项中的物质,能满足如图中阴影部分关系的是( )| ① | ② | ③ | ④ | |
| A | NaCl | K2SO4 | KCl | (NH4)2SO4 |
| B | Na2SO4 | K2SO4 | KCl | NH4Cl |
| C | NaCl | K2SO4 | KCl | NH4Cl |
| D | Na2SO4 | K2SO4 | KCl | (NH4)2SO4 |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=0的溶液中:Fe2+、Na+、Cl-、NO3- | |
| B. | 无色溶液中:Ba2+、Zn2+、Cl-、NO3- | |
| C. | 加入铝粉后能产生气体的溶液中:Mg2+、Ba2+、SO32-、NO3- | |
| D. | 常温下水电离出的c(H+)=10-12的溶液中:Fe3+、K+、ClO-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
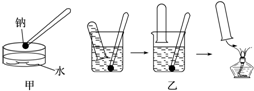 金属钠与水的反应是中学化学中的一个重要反应.该反应的演示方法分别如图甲、乙所示:
金属钠与水的反应是中学化学中的一个重要反应.该反应的演示方法分别如图甲、乙所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从酒精和水的混合物中分离出酒精--蒸馏 | |
| B. | 使浑浊的食盐水变澄清--过滤 | |
| C. | 从碘水中分离出碘--分液 | |
| D. | 把硝酸钾和氯化钾从溶液中分离开来--结晶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com