
【题目】将质量为W1g的钠、铝混合物投入一定量的水中充分反应,金属没有剩余,溶液澄清,共收集到标准状况下的气体V1L。向溶液中逐滴加入浓度为amol/L的盐酸,过程中有白色沉淀生成后又逐渐溶解,当沉淀恰好消失时所加盐酸体积为V2L,将溶液在HCl气氛中小心蒸干得固体W2g。下列所列关系式中正确的是
A. 35.5a=(W2-W1)V2B. n(Al)>![]() mol
mol
C. n(Na)+3n(Al)=![]() molD. aV2=
molD. aV2=![]()
【答案】C
【解析】
钠、铝共融物投入一定量的水中可发生:2Na+2H2O=2NaOH+H2↑,2Al+2NaOH+2H2O=2NaAlO2+3H2↑,加入盐酸体积为V2L时,溶液的溶质为NaCl和AlCl3。
A、W2-W1为氯离子的质量,则W2-W1=a×V2×35.5,故A错误;
B、金属没有剩余,根据方程式可知,n(Na)≥n(Al),而23n(Na)+27n(Al)=W1,联立解得n(Al)≤![]() mol,故B错误;
mol,故B错误;
C、由2Na+2H2O=2NaOH+H2↑,2Al+2NaOH+2H2O=2NaAlO2+3H2↑可知,![]() n(Na)+
n(Na)+![]() n(Al)=
n(Al)=![]() ,故n(Na)+3n(Al)=
,故n(Na)+3n(Al)=![]() mol,故C正确;
mol,故C正确;
D、aV2可以表示氯离子物质的量,根据电荷守恒可知:氯离子物质的量等于金属提供电子物质的量,故aV2=![]() ×2=
×2=![]() ,故D错误;
,故D错误;
故选C。


科目:高中化学 来源: 题型:
【题目】PbI2(亮黄色粉末)是生产新型敏化太阳能电池的敏化剂——甲胺铅碘的原料。合成PbI2的实验流程如图1:


(1)将铅块制成铅花的目的是_____________。
(2)31.05g铅花用5.00mol·L-1的硝酸溶解,至少需消耗5.00 mol·L-1硝酸_______mL。
(3)取一定质量(CH3COO)2Pb·nH2O样品在N2气氛中加热,测得样品固体残留率)(![]() )随温度的变化如图2所示(已知:样品在75℃时已完全失去结晶水)。
)随温度的变化如图2所示(已知:样品在75℃时已完全失去结晶水)。
①(CH3COO)2Pb·nH2O中结晶水数目n=__________(填整数)。
②100~200℃间分解产物为铅的氧化物和一种有机物,则该有机物为___________(写分子式)。
(4)称取一定质量的PbI2固体,用蒸馏水配制成室温时的饱和溶液,准确移取25.00mL PbI2饱和溶液分次加入阳离子交换树脂RH中,发生:2RH(s) + Pb2+(aq) = R2Pb(s) +2H+(aq),用锥形瓶接收流出液,最后用蒸馏水淋洗树脂至流出液呈中性,将洗涤液合并到锥形瓶中。加入2~3滴酚酞溶液,用0.002500mol·L-1NaOH溶液滴定,到滴定终点时用去氢氧化钠标准溶液20.00mL。则室温时PbI2的Ksp为___________。
(5)探究浓度对磺化铅沉淀溶解平衡的影响。
该化学小组根据所提供试剂设计两个实验,来说明浓度对沉淀溶解平衡的影响。
提供试剂:NaI饱和溶液、NaCl饱和溶液、FeCl3饱和溶液、PbI2饱和溶液、PbI2悬浊液。
信息提示:Pb2+和Cl-能形成较稳定的PbCl42-络离子。
请填写下表的空白处:
实验内容 | 实验方法 | 实验现象及原因分析 |
①磺离子浓度增大对平衡的影响 | 取PbI2饱和溶液少量于一支试管中,再滴入几滴NaI饱和溶液 | 现象:溶液中c(I-)增大,使Q大于了PbI2的Ksp |
②铅离子浓度减小对平衡的影响 | ________ | 现象:________ 原因:________ |
③________ | 在PbI2悬浊液中滴入几滴FeCl3饱和溶液 | 现象:黄色浑浊消失 ________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.将少量饱和氯化铁溶液滴入沸水中,继续煮沸,可制得Fe(OH)3胶体,反应的方程式为:FeCl3 + 3H2O ![]() Fe(OH)3(胶体) + 3HCl。
Fe(OH)3(胶体) + 3HCl。
①当溶液呈________时,停止加热,即制得Fe(OH)3胶体。
②氢氧化铁胶体与氢氧化铁沉淀的本质区别是____________________。
③下列叙述错误的是________。(单选)
A.雾属于胶体,能产生丁达尔效应
B.“PM2.5”悬浮在空气中形成胶体,危害人体健康 (“PM2.5”指大气中直径小于或等于2.5微米的细小颗粒物,也可称为可吸入肺颗粒物)
C.明矾、硫酸铁可以净水,净水原理和胶体有关
D.胶体在一定条件下能稳定存在,属于介稳体系
Ⅱ.现有下列纯净物:NaCl、SO3 、CH3COOH、石墨、HCl、蔗糖、乙醇、Fe、NaOH、H2SO4,其中
(1)固态能导电的是_________________________
(2)溶于水后形成的水溶液能导电的是___________________
(3)属于电解质的是_________________________________
(4)属于非电解质的是_________________________________
Ⅲ. 写出以下离子反应的离子方程式
(1)氢氧化钡溶液与硫酸铜混合:__________________________________________________
(2)氢氧化钠溶液中滴入稀硝酸:___________________________________________________
(3)稀盐酸除水垢中的碳酸钙:_____________________________________________________
(4)二氧化碳通入澄清石灰水中:___________________________________________________
(5)硝酸银溶液与稀盐酸反应:_____________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25 ℃时三种金属硫化物的溶度积常数分别是:Ksp(FeS)=6.3×10-18 mol2·L-2、Ksp(CuS)=1.3×10-36 mol2·L-2、Ksp(MnS)=2.5×10-13mol2·L-2,下列说法中正确的是
A. 25 ℃时,FeS的溶解度大于MnS的溶解度
B. 25 ℃时,饱和CuS溶液中,Cu2+的浓度为1.3×10-36 mol·L-1
C. 除去某溶液中的Cu2+,可以选用FeS或MnS作沉淀剂
D. 因为H2SO4是强酸,所以反应CuSO4+H2S=CuS↓+H2SO4不能发生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:N2(g)+3H2(g) ![]() 2 NH3(g) ΔH=-92.4 kJ·mol-1。一定条件下,现有容积相同且恒容的密闭容器甲与乙:① 向甲中通入1 mol N2和3 mol H2,达到平衡时放出热量Q1 kJ;② 向乙中通入0.5 mol N2和1.5 mol H2,达到平衡时放出热量Q2 kJ。则下列关系式正确的是
2 NH3(g) ΔH=-92.4 kJ·mol-1。一定条件下,现有容积相同且恒容的密闭容器甲与乙:① 向甲中通入1 mol N2和3 mol H2,达到平衡时放出热量Q1 kJ;② 向乙中通入0.5 mol N2和1.5 mol H2,达到平衡时放出热量Q2 kJ。则下列关系式正确的是
A. Q1=2Q2=92.4B. 92.4=Q1<2Q2
C. 92.4>Ql>2Q2D. Q1=2Q2<92.4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应过程能量变化如图所示,下列说法正确的是
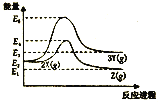
A. 由X→Y反应的ΔH=E2-E3
B. 降低压强有利于提高X→Z的转化率
C. 升高温度有利于提高X→Z的反应速率
D. 由图可知,等物质的量的Y的能量一定比X的能量高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上冶炼锡的第一步反应原理为2SnO2 + 3C![]() 2Sn + aM↑+ CO2↑,则下列说法中错误的是( )
2Sn + aM↑+ CO2↑,则下列说法中错误的是( )
A. 反应中SnO2被还原 B. a的值为3
C. 反应后有两种氧化产物 D. 每生成1 mol CO2转移电子8 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题.

(1)该浓盐酸中HCl的物质的量浓度为 ______ molL-1.
(2)取用任意体积的该盐酸时,下列物理量中不随所取体积的多少而变化的是______ .
A.溶液中HCl的物质的量
B.溶液的浓度
C.溶液中Cl-的数目
D.溶液的密度
(3)配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次并在操作步骤空白处填上适当仪器名称) ______ .
A.用30mL水洗涤 ______ 2~3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用 ______ 加水,使溶液凹液面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线1~2cm处
(4)在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(在括 号内填“偏大”,“偏小”,或“无影响”)
a.用量筒量取浓盐酸时俯视观察凹液面 ______
b.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室里,常用如图所示装置制取并收集氨气。请回答下列问题:
(1)原理与方法
①制取氨气的化学方程式为__________________________________;
②该收集氨气的方法为________。
A.向上排空气法 B.向下排空气法
(2)装置与操作
按下图组装仪器,进行实验。仪器a的名称为____________。

(3)思考与交流
①欲制取标准状况下4.48 L NH3,至少需要NH4Cl________g;
②实验室制取氨气,还可采用下图中的______(填“A”或“B”)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com