
分析 (1)根据n=$\frac{m}{M}$判断二者物质的量之比;同温同压下,气体的体积之比等于物质的量之比;同温同压下,气体密度之比等于摩尔质量的之比;
(2)根据n=$\frac{m}{M}$计算氯化镁物质的量,再根据c=$\frac{n}{V}$计算溶液物质的量浓度,根据配制一定物质的量浓度的溶液的步骤选择使用的仪器;溶液是均一的,取出溶液中溶质浓度等于原溶液中溶质浓度,溶液稀释前后溶质的物质的量不变.
解答 解:(1)根据n=$\frac{m}{M}$可知,等质量的CO和CO2的物质的量之比为44g/mol:28g/mol=11:7,同温同压下,气体的体积之比等于物质的量之比,故等质量的CO和CO2的体积之比为11:7,同温同压下,气体密度之比等于摩尔质量的之比,即CO和CO2的密度之比为28:44=7:11,
故答案为:11:7;11:7;7:11;
(2)9.5gMgCl2的物质的量为$\frac{9.5g}{95g/mol}$=0.1mol,溶于水配成500mL溶液,其浓度为C=$\frac{n}{v}$=$\frac{0.1mol}{0.5L}$=0.2mol/L,配制一定物质的量浓度的溶液步骤为:计算→称量→溶解、冷却→移液→洗涤→定容→摇匀→装瓶→贴签,用托盘天平称取9.5g的氯化镁,在烧杯中溶解,冷却后转移到500mL容量瓶中,并用玻璃棒引流,转移完毕,用少量蒸馏水洗涤烧杯及玻璃棒2~3次并将洗涤液全部转移到容量瓶中,再加适量蒸馏水,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,使溶液的凹液面的最低点与刻线相平,塞好瓶塞,反复上下颠倒摇匀;所以需要的仪器为:托盘天平、烧杯、玻璃棒、500mL容量瓶、胶头滴管,还缺少的玻璃仪器为:500mL容量瓶,没有洗涤烧杯和玻璃捧,会导致溶质的损失,则浓度偏低,从中取出100mL溶液,再加水稀释成500mL,则此时MgCl2溶液的浓度为0.2mol/L×$\frac{100}{500}$=0.04mol/L,
故答案为:0.2;500mL容量瓶;偏小;0.04.
点评 本题考查物质的量有关计算、阿伏加德罗定律的推论等,题目难度不大,注意对基础知识的理解掌握,关键清楚溶液配制的原理,通过c=$\frac{n}{v}$可以加深理解.


科目:高中化学 来源: 题型:选择题
 则下列预测正确的是( )
则下列预测正确的是( )| A. | 该单质很难与其他物质发生反应 | B. | 其最高价氧化物的化学式为XO3 | ||
| C. | 第三层的电子数为8个 | D. | 元素X是一种非金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 实验目的 |
| (滴定前的所有操作正确,已略去) 步骤1: ①用碱式滴定管量取20.00mL的氨水放入锥形瓶中,滴入2滴甲基橙. ②用酸式滴定管取0.1000mol/L盐酸滴定氨水. ③当锥形瓶中的溶液由黄色变成橙色时,停止滴定,纪录数据. ④重复滴定操作2~3次. | 测定氨水的准确浓度 |
| 步骤2:用pH计测定氨水的pH. | 测定氨水中c(OH-)浓度 |
| 步骤3:通过实验数据计算氨水的电离常数K | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向BaCl2溶液中加入足量Na2CO3溶液后,静置,向上层清澈中继续滴加Na2CO3溶液,若无沉淀,说明Ba2+已经完全沉淀 | |
| B. | 淀粉在稀硫酸的作用下水解后,加NaOH溶液使溶液呈碱性,加入新制Cu(OH)2,加热,若有砖红色沉淀生成,说明淀粉已经完全水解 | |
| C. | 将NaSO4•10H2O晶体置于坩埚内加热,称量,并重复上述操作,若相邻两次称量的结果相同,说明硫酸钠已全部失去结晶水 | |
| D. | 用酸式滴定管向滴有酚酞的NaOH溶液中滴加HCl溶液,若滴入最后一滴HCl溶液后红色刚好褪去,且30s内颜色不复原,说明NaOH已完全中和 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
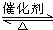 N2+4NH3;为抑制肼的分解,可采取的合理措施有降低反应温度(任写一种).
N2+4NH3;为抑制肼的分解,可采取的合理措施有降低反应温度(任写一种).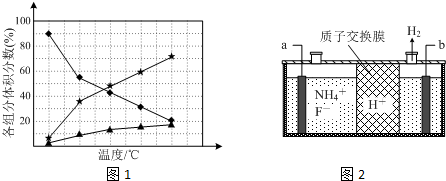
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com