
已知合成尿素的反应为2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g)。将体积比为14:13的NH3与CO2的混合气体置于密闭容器中,若反应达到平衡后增大压强,混合气体的平均相对分子质量 ( )
CO(NH2)2(s)+H2O(g)。将体积比为14:13的NH3与CO2的混合气体置于密闭容器中,若反应达到平衡后增大压强,混合气体的平均相对分子质量 ( )
A.变小 B.增大
C.不变 D.可能增大、减小,也可能不变
C
增大压强,上述平衡将向正反应方向移动。结果,混合气体的总质量减小,混合气体的总物质的量也减小,平均相对分子质量如何变化似乎无法判断。但是仔细分析可以看出:若增大压强使上述平衡向正反应方向移动,混合气体的物质的量每减少2mol,就有1molCO(NH2)2生成,气体的总质量就减少60g,即:△![]() =△m/△n=60g/2mol=30g/mol,这相当于从原混合气体中分离出了一种相对分子质量为30的气体。因此:若原平衡混合气体的
=△m/△n=60g/2mol=30g/mol,这相当于从原混合气体中分离出了一种相对分子质量为30的气体。因此:若原平衡混合气体的![]() >30,平衡正向移动后
>30,平衡正向移动后![]() 增大;若原平衡混合气体的
增大;若原平衡混合气体的![]() = 30,平衡正向移动后
= 30,平衡正向移动后![]() 不变;若原平衡混合气体的
不变;若原平衡混合气体的![]() <30,平衡正向移动后
<30,平衡正向移动后![]() 减小。易求原混合气体的平均相对分子质量为30,因此平衡正向移动后气体的平均相对分子质量不变,始终为30。答案:C。
减小。易求原混合气体的平均相对分子质量为30,因此平衡正向移动后气体的平均相对分子质量不变,始终为30。答案:C。


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源:学习周报 化学 人教课标高二版(选修4) 2009-2010学年 第7期 总第163期 人教课标版(选修4) 题型:013
|
已知工业上合成尿素的反应为 2NH3(g)+CO2(g) | |
| [ ] | |
A. |
减小 |
B. |
增大 |
C. |
不变 |
D. |
增大、减小,也可能不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)如果将CO2和H2以1∶4的比例混合,通入反应器,在适当的条件下反应,可获得一种重要的能源。请完成化学方程式:CO2+4H2![]() _________+2H2O。
_________+2H2O。
(2)若将CO2和H2以1∶3的比例混合,使之发生反应生成某种重要的化工原料和水,则生成的该重要化工原料可能是
A.烷烃 B.烯烃 C.炔烃 D.芳香烃
(3)已知在443 K—473 K时,用钴(Co)作催化剂可使CO2和H2生成C5—C8的烷烃,这是人工合成汽油的方法之一。要达到该汽油的要求,CO2和H2的体积比的取值范围是V(H2):V(CO2):_________________________________________________________________。
(4)已知在一定条件下,合成尿素的反应为:CO2(g)+2NH3(g)![]() CO(NH2)2(s)+H2O(g);ΔH=-127 kJ/mol,在该条件下,将44 g CO2与40 g NH3充分混合,反应放出的热量一定___________(填“大于”“小于”或“等于”)127 kJ。请设计工业合成尿素的条件___________。
CO(NH2)2(s)+H2O(g);ΔH=-127 kJ/mol,在该条件下,将44 g CO2与40 g NH3充分混合,反应放出的热量一定___________(填“大于”“小于”或“等于”)127 kJ。请设计工业合成尿素的条件___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知合成尿素的反应为2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g)。将体积比为14:13的NH3与CO2的混合气体置于密闭容器中,若反应达到平衡后增大压强,混合气体的平均相对分子质量 ( )
CO(NH2)2(s)+H2O(g)。将体积比为14:13的NH3与CO2的混合气体置于密闭容器中,若反应达到平衡后增大压强,混合气体的平均相对分子质量 ( )
A.变小 B.增大
C.不变 D.可能增大、减小,也可能不变
查看答案和解析>>
科目:高中化学 来源:2013-2014学年北京市西城区高三4月一模考试理综化学试卷(解析版) 题型:填空题
氨是重要的化工产品和化工原料。
(1)氨的电子式是 。
(2)已知:

①合成氨的热化学方程式是 。
②降低温度,该反应的化学平衡常数K .(填“增大”、“减小’’或“不变”)。
(3)有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图l所示。
电池正极的电极反应式是 ,A是 。
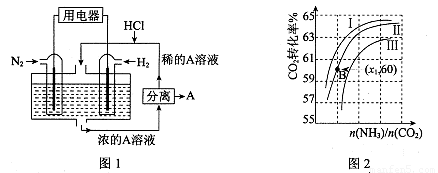
(4)用氨合成尿素的反应为2NH3(g)+CO2(g) CO(NH2)2(l)+ H2O(g)。工业生产时,原料气带有水蒸气。图2表示CO2的转化率与氨碳比
CO(NH2)2(l)+ H2O(g)。工业生产时,原料气带有水蒸气。图2表示CO2的转化率与氨碳比 、水碳比
、水碳比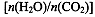 的变化关系。
的变化关系。
①曲线I、II、III对应的水碳比最大的是 。
②测得B点氨的转化率为40%,则x1 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com