
| A. | 2SO2+O2?2SO3 | B. | CO+H20(气)?CO2+H2 | ||
| C. | CO2+H2O?H2CO3 | D. | NaOH+HCl=NaCl+H20 |
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验方案 |
| A | 除去乙烷中少量乙烯 | 将混合气体通入酸性高锰酸钾溶液 |
| B | 检验乙醇和乙酸溶液 | 分别在乙醇和乙酸中加入氢氧化钠溶液 |
| C | 制备少量氯化氢气体 | 向浓硫酸中滴加浓盐酸 |
| D | 证明Fe 3+的氧化性比Cu2+强 | 在氯化铜溶液中加入铁粉、振荡 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
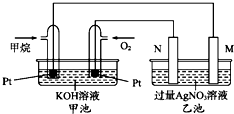 如图是一个甲烷燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时,M、N两个电极的质量都不减少,请回答下列问题:
如图是一个甲烷燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时,M、N两个电极的质量都不减少,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
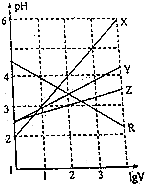 取0.1mol•L-1的NaA和NaB两种盐溶液各1L,分别通入0.02mol CO2,发生如下反应:NaA+CO2+H2O?HA+NaHCO3、2NaB+CO2+H2O?2HB+Na2CO3.则HA和HB的1L溶液分别加水稀释至体积为VL时对应的曲线是( )
取0.1mol•L-1的NaA和NaB两种盐溶液各1L,分别通入0.02mol CO2,发生如下反应:NaA+CO2+H2O?HA+NaHCO3、2NaB+CO2+H2O?2HB+Na2CO3.则HA和HB的1L溶液分别加水稀释至体积为VL时对应的曲线是( )| A. | X是HA、Z是HB | B. | Y是HA、Z是HB | C. | Z是HA、R是HB | D. | Z是HA、Y是HB |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1g H2含有的氢原子数目为NA | |
| B. | 常温常压下,22.4L O2含有的分子数目为NA | |
| C. | 1L1mol•L-1KOH溶液中含有的钾离子数目为NA | |
| D. | 1molZn变为Zn2+失去的电子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 通常把拆开1mol某化学键所吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H).化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.
通常把拆开1mol某化学键所吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H).化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.| 化学键 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C |
| 键能/kJ•mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com