
| A.1 L 0.3 mol·L-1 CH3COOH溶液和3 L 0.1 mol·L-1 CH3COOH溶液中的H+数 |
| B.纯水在25℃和80℃时的pH |
| C.在NH3+NO→N2+H2O反应中,被氧化和被还原的N原子数 |
| D.相同条件下,H2分别与Cl2、F2反应的反应速率 |


科目:高中化学 来源:不详 题型:单选题
 2Z(g) △H<0。一段时间后达到平衡,反应过程中测定的数据如下表:
2Z(g) △H<0。一段时间后达到平衡,反应过程中测定的数据如下表:| t/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 bZ(g) △H<0。下图是容器中X、Z的物质的量浓度随时间变化的曲线。
bZ(g) △H<0。下图是容器中X、Z的物质的量浓度随时间变化的曲线。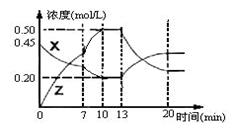
| A.用X表示0~10min内该反应的平均速率为v(X)=0.045mol/(L·min) |
| B.化学方程式中a:b= 1:3, |
| C.推测在第7min时曲线变化的原因可能是增加X的浓度 |
| D.推测该反应处于化学平衡状态的时间是10min--13min及第20min 后 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2C(g),?H=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2 mol A和1 mol B,在500 ℃时充分反应达平衡后C的浓度为ω mol/L,放出热量为b kJ。
2C(g),?H=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2 mol A和1 mol B,在500 ℃时充分反应达平衡后C的浓度为ω mol/L,放出热量为b kJ。| T/K | T1 | T2 | T3 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
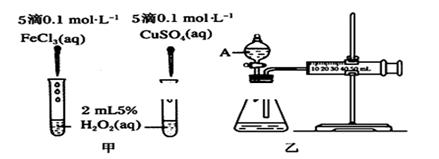

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
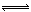 CH3OH(g),根据题意,以下说法正确的是
CH3OH(g),根据题意,以下说法正确的是
| A.E点的平衡常数大于D点的平衡常数,且该反应的ΔH <0 |
| B.容器中气体的总物质的量E点大于D点 |
| C.当容器内气体密度不变时,说明该反应已达到平衡状态 |
D.v(甲醇)=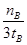 mol/(L·min)-1表示500 ℃以上反应在D点的速率 mol/(L·min)-1表示500 ℃以上反应在D点的速率 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.实验室制氢气,为了加快反应速率,可向稀H2SO4中滴加少量Cu(NO3)2溶液 |
| B.为处理锅炉水垢中的CaSO4,可先用饱和Na2CO3溶液浸泡,再加入盐酸溶解 |
C.反应N2(g)+3H2(g) 2NH3(g)△H<0平衡时,其他条件不变,升高温度,再次达到平衡时氢气转化率增大 2NH3(g)△H<0平衡时,其他条件不变,升高温度,再次达到平衡时氢气转化率增大 |
D.吸热反应“TiO2(s)+2Cl2(g) TiCl4(g)+O2(g)”在一定条件下可自发进行,则该反应的△S<0 TiCl4(g)+O2(g)”在一定条件下可自发进行,则该反应的△S<0 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
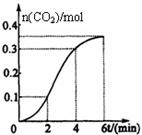
| A.反应开始2分钟内平均反应速率最大 |
| B.反应4分钟后平均反应速率最小 |
| C.反应开始4分钟内温度对反应速率的影响比浓度大 |
| D.反应4分钟后反应速率下降的原因是盐酸浓度逐渐减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com