
| A. | 常温常压下溶解度:CaCO3<Na2CO3<NaHCO3 | |
| B. | 氧化性:Mg2+<H+<Cu2+<Fe3+ | |
| C. | 酸性:H4SiO4<H3PO4<H2SO4<HClO | |
| D. | 沸点:SiC>I2>Si>HF |
分析 A、常温时,Na2CO3溶解度较大;
B、氧化性为Fe3+>Cu2+,金属活动顺序表中,排在后边的金属阳离子氧化性强;
C、元素的最高价含氧酸酸酸性和元素的非金属性有关系;
D、原子晶体的沸点高于分子晶体.
解答 解:A、常温时,Na2CO3溶解度较大,所以溶解度顺序:CaCO3<NaHCO3<Na2CO3,故A错误;
B、氧化性为Fe3+>Cu2+,金属活动顺序表中,排在后边的金属阳离子氧化性强,即氧化性:Mg2+<H+<Cu2+<Fe3+,故B正确;
C、元素的最高价含氧酸酸酸性和元素的非金属性有关系,酸性:H4SiO4<H3PO4<H2SO4<HClO4,故C错误;
D、原子晶体的沸点高于分子晶体,HF分子之间存在氢键,所以沸点高于I2,故D错误.
故选B.
点评 本题考查较为综合,涉及氢键、氧化性比较、溶解度比较等问题,综合考查学生的分析能力和基础知识的综合应用,注意把握相关基础知识,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
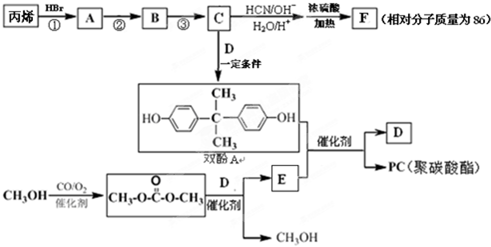

 .
.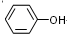 .
. .
.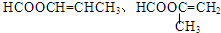 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
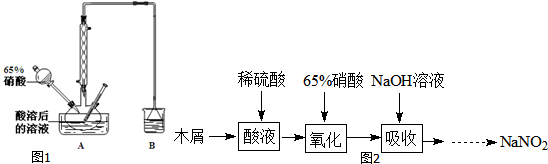
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 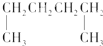 1.4-二甲基丁烷 1.4-二甲基丁烷 | B. | 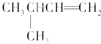 3-甲基丁烷 3-甲基丁烷 | ||
| C. | 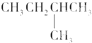 2-甲基丁烷 2-甲基丁烷 | D. | CH2Cl-CH2Cl 二氯乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
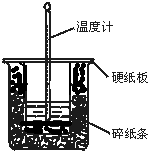 50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1NaOH溶液在图示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1NaOH溶液在图示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
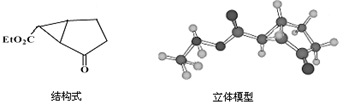
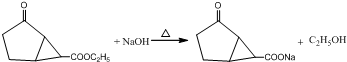 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③⑤⑥ | B. | ①② | C. | ③⑤ | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
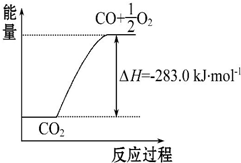 已知:①CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283.0kJ•mol-1
已知:①CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283.0kJ•mol-1| A. | 通常状况下,氢气的燃烧热为241.8 kJ•mol-1 | |
| B. | 由①可知,1 mol CO(g)和$\frac{1}{2}$mol O2(g)反应生成1 mol CO2(g),放出283.0 kJ的热量 | |
| C. | 可用右图表示2CO2(g)═2CO(g)+O2(g)反应过程中的能量变化关系 | |
| D. | 分解1 mol H2O(g),其反应热为-241.8 KJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com