
����Ŀ����֪����KI�����ᡢ�Լ�X�͵���������Һ��ϣ���Ӧ���������ټ���˫��ˮ����������Ӧ��H2O2+2H++2I-��2H2O+I2�������ɵ�I2�������Լ�X��Ӧ�������ġ�һ��ʱ����Լ�X������Ӧ���ɵ�I2��ȫ���ġ�������Һ�е�I-������H2O2���������ɵ�I2��������ã���Һ������������ˣ������Լ�X����������˫��ˮ����Һ���������ʱ�䣬�������㷴ӦH2O2+2H++2I-��2H2O+I2�ķ�Ӧ���ʡ�
���Ϊijͬѧ��������ԭ����Ƶ�ʵ�鼰ʵ���¼����ʵ��������������½��У���
��� | ���ձ��м�����Լ�����������mL�� | ���� | ��ʼ����ʱ�䣨min�� | ||||
0.1mol��L��1KI��Һ | H2O | 0.01mol��L��1X��Һ | 0.1mol��L��1˫��ˮ | 1mol��L��1ϡ���� | |||
1 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | �� | 1.4 |
2 | 20.0 | m | 10.0 | 10.0 | n | �� | 2.8 |
3 | 10.0 | 20.0 | 10.0 | 20.0 | 20.0 | �� | 2.8 |
4 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 5��Fe2(SO4)3 | 0.6 |
��1����֪��ʵ��1��2��Ŀ����̽��H2O2Ũ�ȶ�H2O2+2H++2I-��2H2O+I2��Ӧ���ʵ�Ӱ�졣ʵ��2��m=___��n=___��
��2����֪��I2��X��Ӧʱ���������ʵ���֮��Ϊ1��2����������е�X��KI�ļ�����������V��H2O2��>___����ȷ��������ɫ��
��3��ʵ��1��Ũ��c(X)�� t�ı仯������ͼ�������������������䣬���ڴ������ͼ�У��ֱ�ʵ��3��ʵ��4��c(X)��t�ı仯����ͼ��������Ӧ�ı�ע����____
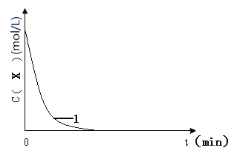
��4��ʵ��3����������������߷�Ӧ���ʡ������ܼӿ췴Ӧ��������Ϊ����___(���ߡ����͡�)�˷�Ӧ��ܡ�
���𰸡�20.0 20.0 0.5mL 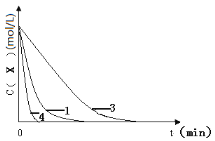 ����
����
��������
(1)���ݶԱ�ʵ���Ŀ�Ŀ�֪��ʵ��1��2��Ŀ����̽��H2O2Ũ�ȶ�H2O2+2H++2I��2H2O+I2��Ӧ���ʵ�Ӱ�죬ֻ�ı�˫��ˮŨ��,����������ͬ���������Ũ�Ȳ��䣬������������ֲ��䣬��n=20.0������ʵ��1������Һ�����Ϊ(20.0+10.0+10.0+20.0+20.0)mL��ʵ��2������Һ�������Ϊ(20.0+m+10.0+10.0+n)������ʵ��1��2������Һ���������ͬ��n=20.0����m=20.0��
�ʴ�Ϊ��20.0��20.0��
(2)�������������֪X�����ʵ���n(X)=c��V=0.01molL1��0.01L=1.0��104mol�� I2��X��Ӧʱ���������ʵ���֮��Ϊ1:2������I2�����ʵ���Ϊ5.0��105mol�����ݻ�ѧ����ʽH2O2+2H++2I�T2H2O+I2�������ҪH2O2�����ʵ���Ϊ5.0��105mol���ݴ����˫��ˮ�����V(H2O2)=![]() =0.5mL��Ϊ��ȷ��������ɫ��n(I2)һ������0.5��10��4mol��n(H2O2)һ������0.5��10��4mol����V(H2O2)>0.5mL��
=0.5mL��Ϊ��ȷ��������ɫ��n(I2)һ������0.5��10��4mol��n(H2O2)һ������0.5��10��4mol����V(H2O2)>0.5mL��
�ʴ�Ϊ��0.5mL��
(3)����KI��˫��ˮ���������������X����Ӧ��ȫ��ʵ��1��3��4��X����ʼŨ����ͬ����ӦֹͣʱX��Ũ��Ҳ��Ϊ0��ʵ��1��ʵ��3������С�⻯����Һ��Ũ�ȣ���Ӧ���ʼ�С��X��Ũ������ʼŨ�ȼ�С��0��ʱ������ʵ��3��ʵ��1�������յ�ֵ��ͬ���м���̵�������ʵ��1���ߵ��ұߣ���Ӧ��ʱ���ʵ��1����ʵ��1��ʵ��4������������ͬ����ʹ���˴�������Ӧ���ʼӿ죬X��Ũ������ʼŨ�ȼ�С��0��ʱ�����̣�ʵ��4��ʵ��1�������յ�ֵ��ͬ���м���̵�������ʵ��1���ߵ���ߣ���Ӧ��ʱ���ʵ��1�٣��ݴ˿��Ի�ͼΪ�� ��
��
�ʴ�Ϊ�� ��
��
(4)��������Һ�Ǹ÷�Ӧ�Ĵ������ܼӿ췴Ӧ���ʣ�ԭ���Ǵ����ܽ��ͷ�Ӧ�Ļ�ܣ�
�ʴ�Ϊ�����ͣ�


 �������ͬ������ϵ�д�
�������ͬ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������绯ѧϵͳ�������о�����һ���������������オ���л���ˮ����������������ԭ�����������ؽ�����ˮ��ij���ױ�����������ͼ��ʾװ�ÿ�ʹ��������۸�����(Cr2O72��)��ֱ�ӽӴ���������Ũ�Ⱥ�����ˮ��װ�ù���ʱ������˵���������( )
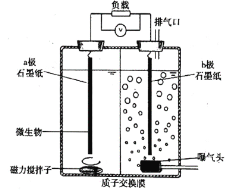
A.![]() ������
������![]() ����
����
B.��װ����������������Ӻ�![]()
C.![]() ��ʯīֽ������Ӧ��
��ʯīֽ������Ӧ��![]()
D.���ø�װ��ԭ�����ܴ���������ˮ������ͬ�����յ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������ƶ�������еĶ���ű������ű������ű������λҩ���з����ٴ�ר���о����֣���ҩ����ϸ��ˮƽ������Ч��������״�����ĸ�Ⱦ��
(1)����������ɶ���Ԫ���γɵ����ʣ�������Ԫ�صĻ�̬��ԭ�ӣ�����ռ�ݵ�����ܲ����Ϊ_____����Ԫ�صļ��⻯��PH3������ԭ���ӻ���ʽ��_____������_______(���������������Ǽ�����)���ӣ�����������Ԫ�صĵ�һ�����ܴӴ�С��˳��Ϊ_________��
(2)N��PΪͬ��Ԫ�أ��Ƚ�������������ˮ�������Բ��ӽṹ�ĽǶ�˵�����ɣ�________
(3)H3PO4��Fe3+�γ�H3[Fe(PO4)2]�������ʳ������ڱ���Һ�е�Fe3+����̬Fe3+�ĺ�������Ų�ʽΪ___________��![]() ��Ϊ����Ϊ�������ṩ______��
��Ϊ����Ϊ�������ṩ______��
(4)��ͭ(Cu3P2)������������ͭ������ͭ�Ǻ�����������ͭ�Ͻ���Ҫ������ĥ����͵���ԭ�����侧���ṹ��ͼ��ʾ��
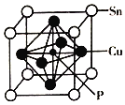
���仯ѧʽΪ__________
��ͭ��ͭ�ε���ɫ��ӦΪ_____ɫ������Ԫ���ܲ�����ɫʵ�����ԭ��Ϊ______��
���������ܶ�Ϊ��g/cm3��Ħ������ΪMg/mol��NA���������ӵ��������������Cuԭ�Ӻ˼��Ϊ________________pm��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ɷ�Ӧ��Xת��ΪY��Z�������仯��ͼ��ʾ������˵��������ǣ� ��
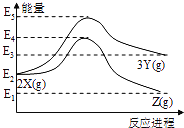
A. ��![]() ��Ӧ����H >0
��Ӧ����H >0
B. ��![]() ��Ӧ����H = (E2��E1) kJ/mol
��Ӧ����H = (E2��E1) kJ/mol
C. ����ѹǿ���������Y�IJ���
D. �����¶����������Z�IJ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����O2��NH3�Ļ������448mLͨ�����ȵ���������������ַ�Ӧ����ͨ��������ˮ�������ռ���44.8mL���塣ԭ���������O2����������ǣ����谱ȫ��������������������ѻ���ɱ�״����
A. 231.5mL B. 268.8mL C. 287.5mL D. 313.6mL
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼ�жϣ�����˵����ȷ����(����)
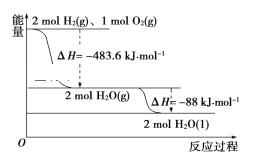
A. ������ȼ������H����241.8 kJ��mol��1
B. 2 mol H2(g)��1mol O2(g)�������������2 mol H2O(g)�������������
C. Һ̬ˮ�ֽ���Ȼ�ѧ����ʽΪ2H2O(l)=2H2(g)��O2(g)����H����571.6 kJ��mol��1
D. H2O(g)����H2O(l)ʱ���ϼ����յ�����С�ڳɼ��ų�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й��Ȼ�ѧ����ʽ��������ȷ���ǣ� ��
A. ��֪2H2(g)+O2(g) =2 H2O(g) ��H=��483.6kJ��mol-1����������ȼ���ȡ�H=��241.8 kJ/mol
B. ��֪2C(s)+2O2(g)=2CO2(g)��H1��2C(s)+O2(g)=2CO(g)��H2�����H1>��H2
C. ��20.0g NaOH��ϡ��Һ��ϡ������ȫ�кͣ��ų�28.7kJ����������ϡ�����ϡNaOH��Һ��Ӧ���Ȼ�ѧ����ʽΪ�� NaOH(aq)+CH3COOH(aq) = CH3COONa(aq) + H2O(l) ��H =��57.4kJ��mol-1
D. CO(g)��ȼ������283.0 kJ/mol����2CO2(g)=2CO(g)+O2(g) ��H=+566.0 kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����ͭ��ϡ����ķ�ӦΪ3Cu��8HNO3===2NO����4H2O��3Cu(NO3)2(Cu�����ԭ������Ϊ64)���ְ�19.2 g Cu����200 mL 5 mol��L��1�����У���ַ�Ӧ���ʣ�
��1���������ʹ�����______
��2���μӷ�Ӧ����������ʵ���Ϊ���٣�______
��3���ڱ�״���²�������������Ϊ���٣�______
��4������ˮ�ķ�����Ϊ���٣�______
��5������Ӧǰ����Һ��������䣬������Cu(NO3)2�����ʵ���Ũ��Ϊ���٣�______
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��O2��O3����Ԫ�ص����ֵ��ʣ����������ʽ������и��⣺
��1����������O2��O3����ԭ�Ӹ�����Ϊ__�����ӵ����ʵ���֮��Ϊ__��
��2�����¡���ѹ�£��������O2��O3�������Ӹ�����Ϊ__��������Ϊ___��
��3����NAΪ�����ӵ���������ֵ�����ag�����к��еķ�����Ϊb����cg�����ڱ�״���µ����Լ��___(�ú�NA��ʽ�ӱ�ʾ)��
��4�������£���20g��������Ϊ14%��KNO3��Һ��30g��������Ϊ24%��KNO3��Һ��ϣ��õ��ܶ�Ϊ1.15g��cm-3�Ļ����Һ���û����Һ�����ʵ���Ũ��Ϊ___mol��L-1��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com