
| A、③⑥ | B、①③⑥ |
| C、①③④⑥ | D、①②⑤⑥ |
| 5 |
| 3 |
| 1 |
| 2 |
| 3 |
| 2 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
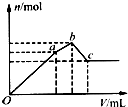 向100mL0.1mol?L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1mol?L-1Ba(OH)2溶液.随着Ba(OH)2溶液体积(V)的变化,沉淀总物质的量(n)的变化如图所示.下列叙述正确的是( )
向100mL0.1mol?L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1mol?L-1Ba(OH)2溶液.随着Ba(OH)2溶液体积(V)的变化,沉淀总物质的量(n)的变化如图所示.下列叙述正确的是( )| A、a点的沉淀总物质的量为0.03mol |
| B、Oa段发生反应的离子方程式是:Al3++2SO42-+2Ba2++3OH-═Al(OH)3↓+2BaSO4↓ |
| C、ab段发生反应的离子方程式是:2NH42++SO42-+Ba2++2OH-═2NH3?H2O+BaSO4↓ |
| D、反应到c点时,加入Ba(OH)2溶液的总体积为250mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2CO3溶液与稀盐酸 |
| B、CuSO4溶液与BaCl2溶液 |
| C、稀H2SO4与NaCl溶液 |
| D、稀HNO3与Ba(OH)2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,11.2L乙烯含有的极性共价键数为NA |
| B、常温下,5.6LNO和5.6LO2的混合气体中含有的分子数为0.5NA |
| C、16.9gBaO2固体中阴、阳离子总数为0.2NA. |
| D、常温常压下,28g氮气含有的核外电子数为10 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、① | B、② | C、③ | D、④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 预期现象和结论 |
| 步骤1:取1mLA溶液于一试管中,加入约2mL的CCl4,充分振荡后静置. | |
| 步骤2: |
查看答案和解析>>
科目:高中化学 来源: 题型:
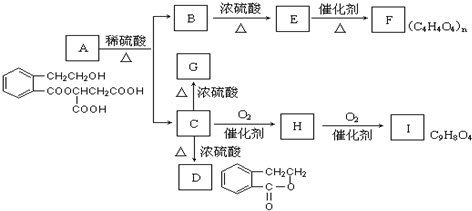
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com