
向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应SO2(g)+NO2(g) SO3(g)+NO(g),达到平衡,正反应速率随时间变化的示意图如下所示。由图可得出的正确结论是
SO3(g)+NO(g),达到平衡,正反应速率随时间变化的示意图如下所示。由图可得出的正确结论是
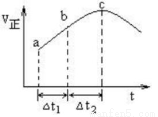
A.反应在c点达到平衡状态
B.反应物浓度:a点小于b点
C.反应物的总能量低于生成物的总能量
D.△t1=△t2时,SO2的转化率:a~b段小于b~c段
科目:高中化学 来源:2017届山东省高三上第一次质检化学试卷(解析版) 题型:选择题
下列有关化学基本概念的判别正确的是:( )
A.氧化还原反应的本质是元素化合价的升降
B.分散系分为溶液、胶体和浊液的依据:分散质微粒直径大小
C.某元素由化合态变为游离态,此元素一定被还原
D.强电解质与弱电解质:溶液的导电能力大小
查看答案和解析>>
科目:高中化学 来源:2017届湖北省高三上第四次质检化学试卷(解析版) 题型:选择题
室温下,将1mol的CuSO4•5H2O(s)溶于水会使溶液温度降低,热效应为△H1,将1mol的CuSO4(s)溶于水会使溶液温度升高,热效应为△H2:CuSO4•5H2O受热分解的化学方程式为CuSO4•5H2O(s)  CuSO4(s)+5H2O(l),热效应为△H3,则下列判断正确的是( )
CuSO4(s)+5H2O(l),热效应为△H3,则下列判断正确的是( )
A.△H2>△H3 B.△H1<△H3
C.△H1+△H3=△H2 D. △H1+△H2>△H3
查看答案和解析>>
科目:高中化学 来源:2017届海南省高三上10月月考化学试卷(解析版) 题型:选择题
在强酸性溶液中能大量共存并且溶液为无色透明的离子组是( )
A、Ca2+、Na+、NO3-、CO32- B、Mg2+、C1-、NH4+、SO42-
C、K+、Cl-、HCO3-、NO3- D、Ca2+、Na+、Fe2+、NO3-
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上期中化学卷(解析版) 题型:填空题
二氧化碳的捕捉和利用是我国能源领域的一个重要战略方向。
(1)用活性炭还原法可以处理汽车尾气中的氮氧化物,某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s)+2NO(g) N2(g)+CO2(g)ΔH,在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
N2(g)+CO2(g)ΔH,在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
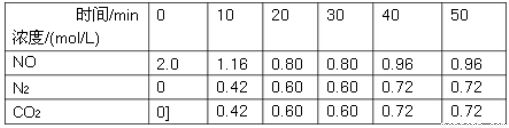
①根据图表数据分析T1℃时,该反应在0-20min的平均反应速率v(N2)=________mol/(L•min);计算该反应的平衡常数K=___________。
②30min后,只改变某一条件,根据上表的数据判断改变的条件可能是________(填字母代号)。
A.加入合适的催化剂
B.适当缩小容器的体积
C.通入一定量的NO
D.加入一定量的活性炭
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则达到新平衡时NO的转化率________(填“升高”或“降低”),ΔH________0(填“>”或“<”).
(2)工业上用CO2和H2反应合成二甲醚。已知:
CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H1=-49.1kJ/mol
CH3OH(g)+H2O(g)△H1=-49.1kJ/mol
2CH3OH(g) CH3OCH3(g)+H2O(g)△H2=-24.5kJ/mol
CH3OCH3(g)+H2O(g)△H2=-24.5kJ/mol
写出CO2(g)和H2(g)转化为CH3OCH3(g)和H2O(g)的热化学方程式__________________。
(3)二甲醚燃料电池具有能量转化率高、电量大的特点而被广泛应用,一种二甲醚氧气电池(电解质为KOH溶液)的负极反应式为:__________________
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上期中化学卷(解析版) 题型:选择题
青铜器的制造是中华民族劳动人民智慧的结晶,成为一个时代的象征,但出土的青铜器大多受到环境腐蚀。如图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图。环境中的Cl-扩散到孔口,并与各电极产物作用生成多孔粉状锈Cu2(OH)3Cl。下列说法不正确的
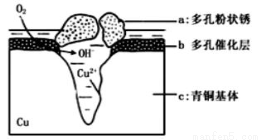
A.腐蚀过程中,负极c被氧化
B.环境中的Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,其离子方程式为2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓
C.若生成2.145gCu2(OH)3Cl,则理论上消耗标准状况氧气体积为0.448L
D.正极的电极反应式为:正极反应是O2+4e-+2H2O=4OH-
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上期中化学卷(解析版) 题型:选择题
下列说法正确的是
A.理论上任何氧化还原反应都可以设计成原电池。
B.甲烷的标准燃烧热为890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ/mol
C.500℃、30MPa下,将0.5molN2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为N2(g)+3H2(g) 2NH3(g)△H=-38.6 kJ/mol
2NH3(g)△H=-38.6 kJ/mol
D.同温同压下,等量的氢气完全发生反应:H2(g)+Cl2(g)=2HCl(g),在点燃条件下放出的热量与光照条件下放出的热量相等。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上期中化学卷(解析版) 题型:选择题
下列说法正确的是
A.常温下将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4
B.用蒸馏水润湿的试纸测溶液的pH,一定会使结果偏低
C.25℃时,用醋酸溶液滴定等浓度的NaOH溶液至pH=7,V醋酸>VNaOH
D.100℃时,将pH =2的盐酸与pH =12的NaOH溶液等体积混合,溶液呈中性
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上期中化学卷(解析版) 题型:填空题
研究硫元素及其化合物的性质具有重要意义。
Ⅰ.25℃,在0.10mol·L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-) 关系如图(忽略溶液体积的变化、H2S的挥发)。
①pH=13时,溶液中的c(H2S)+c(HS-)= mol·L-1.
②某溶液含0.020 mol·L-1Mn2+、0.10 mol·L-1H2S,当溶液pH= 时,Mn2+开始沉淀。[已知:Ksp(MnS)=2.8×10-13]
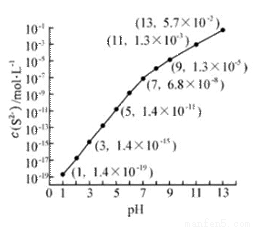
Ⅱ.在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g) 2SO3(g)(Q>0)
2SO3(g)(Q>0)

(1)600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间是____________。
(2)据图判断,反应进行至20min时,曲线发生变化的原因是______________(用文字表达)10min到15min的曲线变化的原因可能是______________(填写编号)。
a.加了催化剂 b.缩小容器体积 c.降低温度 d.增加SO3的物质的量.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com