
【题目】某实验小组探究AgNO3溶液与Na2SO3溶液的反应。
实验I | 操作 | 现象 |
| 滴加5滴0.1mol/L Na2SO3溶液,振荡 | 产生白色沉淀,测得混合溶液pH=5 |
继续滴加0.1mol/L Na2SO3溶液,振荡 | 白色沉淀增多,继续滴加,白色沉淀消失,测得混合溶液pH=9 |
资料:Ag2SO3,白色固体,难溶于水;Ag2SO4,白色固体,微溶于水;AgOH,白色固体,常温下不稳定,易分解产生棕褐色固体。
(1)测得0.1mol/L Na2SO3溶液pH=10,用离子方程式解释原因:_______。
(2)实验小组对白色沉淀的成分提出猜想:
①可能含Ag2SO3。
②可能含Ag2SO4,理由是________。
③可能含AgOH。
实验产生的白色沉淀放置一段时间后未发生明显变化,排除猜想③。
(3)检验白色沉淀的成分
(资料:Ag++2S2O32![]() Ag(S2O3)23,Ag(S2O3)23在溶液中稳定存在。)
Ag(S2O3)23,Ag(S2O3)23在溶液中稳定存在。)
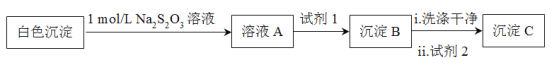
测得沉淀C质量小于沉淀B,试剂1和试剂2分别是_____、______,说明白色沉淀是Ag2SO3和Ag2SO4的混合物。
(4)探究白色沉淀消失的原因。实验小组设计对照实验:
实验II | 实验III | |
实验操作 |
|
|
现象 | 沉淀溶解 |
① 补充实验III的实验操作及现象:_______,证明SO32使白色沉淀溶解。
② 查阅资料:Ag2SO3能溶于过量Na2SO3溶液中形成Ag(SO3)23。白色沉淀中含有g2SO4,但还能全部溶解于Na2SO3溶液的原因是______。
(5)探究AgNO3溶液与Na2SO3溶液能否发生氧化还原反应。
实验IV | 操作 | 现象 |
| 步骤i:滴加一定体积0.1 mol/L Na2SO3溶液 | 产生白色沉淀 |
步骤ii:再加入NaOH溶液调pH=14,振荡 | 白色沉淀变黑,经检验为Ag |
步骤ii中Ag2SO3发生反应的离子方程式是_________。
(6)综合实验I和IV,说明AgNO3溶液与Na2SO3溶液的反应类型与_______有关。
【答案】SO32+H2O![]() HSO3+OH SO32可能被O2氧化 Ba(NO3)2溶液 盐酸溶液 操作:滴加NaOH溶液至pH=9,现象:白色沉淀不溶解 Ag2SO4微溶,溶液中存在SO32,Ag2SO4易转化为更难溶的Ag2SO3,进而被Na2SO3溶液溶解。 Ag2SO3+2OH== 2Ag+SO42+H2O 反应物的相对浓度、pH
HSO3+OH SO32可能被O2氧化 Ba(NO3)2溶液 盐酸溶液 操作:滴加NaOH溶液至pH=9,现象:白色沉淀不溶解 Ag2SO4微溶,溶液中存在SO32,Ag2SO4易转化为更难溶的Ag2SO3,进而被Na2SO3溶液溶解。 Ag2SO3+2OH== 2Ag+SO42+H2O 反应物的相对浓度、pH
【解析】
试验I在AgNO3溶液中滴加Na2SO3溶液生成白色沉淀,可以考虑生成Ag2SO3沉淀;同时考虑亚硫酸盐易被空气中的氧气氧化,又可以考虑白色沉淀中有Ag2SO4;加入的Na2SO3溶液呈碱性,所以还可以考虑AgOH。随着Na2SO3溶液滴入量的增加,PH值也逐渐增大,沉淀先增加后溶解,可见该反应与反应物的用量和PH有关。
小题(3)是对于白色沉淀的检验:用Na2S2O3溶液溶解沉淀,使Ag+结合成Ag(S2O3)23而溶解,释放出白色沉淀中的阴离子,再用可溶钡盐+盐酸检验可能的SO32和SO42。
小题(4)是对于白色沉淀溶解的原因探究:根据所给信息,沉淀的溶解应是生成了Ag(SO3)23。溶解过程中有两个量在变:Na2S2O3的量和PH,因此可从这两方面进行探究。
小题(5)是探究AgNO3溶液与Na2SO3溶液能否发生氧化还原反应:根据实验现象可直接判断。
(1) Na2SO3溶液呈碱性的原因是弱酸根离子SO32的水解:SO32+H2O![]() HSO3+OH,故答案为:SO32+H2O
HSO3+OH,故答案为:SO32+H2O![]() HSO3+OH
HSO3+OH
(2)+4价硫的还原性较强,易被氧化。根据实验环境,可考虑Ag+或O2,由于Ag+的还原产物Ag为黑色,可排除,所以可能产生Ag2SO4的理由是SO32可能被O2氧化,故答案为:SO32可能被O2氧化
(3) 对于白色沉淀的检验:用Na2S2O3溶液溶解沉淀,使Ag+结合成Ag(S2O3)23而溶解,释放出白色沉淀中的阴离子,再用可溶钡盐将可能的SO32和SO42沉淀,分离出的沉淀用盐酸溶解,如果能全溶解,则不含SO42,如果不能全溶解,则含SO42,故答案为:Ba(NO3)2溶液;盐酸溶液
(4) ①为证明是SO32是使白色沉淀溶解的原因,本题设计了对照试验,为此要控制好变量,排除溶液PH值的影响,即应在对照组的白色沉淀中滴加NaOH溶液至PH=9,故答案为:操作:滴加NaOH溶液至pH=9,现象:白色沉淀不溶解
②Ag2SO4在水中存在溶解平衡:Ag2SO4(s) ![]() Ag+(aq)+ SO42(aq),加入的SO32将Ag+结合成溶解性更小的Ag2SO3,c(Ag+)降低,促进Ag2SO4转化成Ag2SO3,并进一步转化成Ag(SO3)23,直至完全溶解,故答案为:Ag2SO4微溶,溶液中存在SO32,Ag2SO4易转化为更难溶的Ag2SO3,进而被Na2SO3溶液溶解
Ag+(aq)+ SO42(aq),加入的SO32将Ag+结合成溶解性更小的Ag2SO3,c(Ag+)降低,促进Ag2SO4转化成Ag2SO3,并进一步转化成Ag(SO3)23,直至完全溶解,故答案为:Ag2SO4微溶,溶液中存在SO32,Ag2SO4易转化为更难溶的Ag2SO3,进而被Na2SO3溶液溶解
(5) 试验IV通过改变沉淀所在环境的PH来探究AgNO3溶液与Na2SO3溶液能否发生氧化还原反应。从试验现象及产物可知,加入NaOH溶液至pH=14时发生了氧化还原反应,生成了Ag,可知S应被氧化成SO42,所以反应离子方程式为: Ag2span>SO3+2OH== 2Ag+SO42+H2O,故答案为:Ag2SO3+2OH== 2Ag+SO42+H2O
(6) 根据试验I和IV及以上分析可知: AgNO3溶液与Na2SO3溶液在PH=5时先生成Ag2SO3,发生的是复分解反应;如果提高Na2SO3溶液的相对浓度(即加入过量的Na2SO3溶液至PH=9)又溶解为络合离子Ag(SO3)23;而如果提高碱性至PH=14时生成的是Ag和SO42,发生的是氧化还原反应。所以两者的反应类型与反应物的相对浓度、pH都有关,故答案为:反应物的相对浓度、pH


科目:高中化学 来源: 题型:
【题目】下表是第三周期部分元素的电离能数据,下列说法正确的是( )
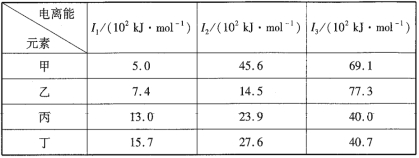
A.甲的金属性比乙弱B.乙的最高正化合价为+1
C.丙一定为非金属元素D.丁一定是金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与有机物的结构、性质的有关叙述中正确的是( )
A.等物质的量的乙烯与乙醇完全燃烧消耗氧气的物质的量相等
B.乙烯、氯乙烯、聚乙烯均可使酸性高锰酸钾溶液褪色
C.分馏、干馏都是物理变化,裂化、裂解都是化学变化
D.苯乙烯和甲苯分子内所有原子可能共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化合物的结构(键线式)及球棍模型如下:
该有机分子的核磁共振氢谱图如下(单位是ppm):
![]()
化学位移5
下列关于该有机物的叙述正确的是
A. 该有机物属于芳香族化合物
B. 键线式中的Et代表的基团为-CH3
C. 该有机物不同化学环境的氢原子有8种
D. 该有机物在氢氧化钠醇溶液加热的情况下能发生消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的说法正确的是
A. 苯佐卡因(![]() )是局部麻醉药,分子中含有2种官能团,分子式为C9H10NO2
)是局部麻醉药,分子中含有2种官能团,分子式为C9H10NO2
B. 香叶醇( )能发生加成反应不能发生取代反应
)能发生加成反应不能发生取代反应
C. 青蒿素(![]() ) 的一氯代物有5种(不含立体异构)
) 的一氯代物有5种(不含立体异构)
D. 某有机物的分子式为C4H8,能使溴的CCl4溶液褪色,则它在一定条件下与水反应时最多可生成的有机物(不考虑立体异构)有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为一种特殊的热激活电池示意图,当无水LiCl-KCl混合物受热熔融后即可工作。该电池总反应为:PbSO4(s)+2LiCl+Ca(s) = CaCl2(s)+Li2SO4+Pb(s)。下列说法不正确的是( )
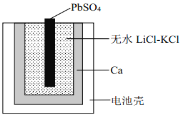
A.PbSO4电极发生还原反应
B.负极的电极反应:Ca + 2Cl--2e-=CaCl2
C.用LiCl和KCl水溶液代替无水LiCl-KCl,可将该电池改为常温使用的电池
D.放电时 Li+、 K+向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2 和CH4是常见的化合物,同时也是常用的化工原料。
Ⅰ.以CO2与NH3为原料可以合成尿素[CO(NH2)2]。合成尿素的反应为2NH3(g) + CO2(g) ![]() CO(NH2)2(s) + H2O(g)。
CO(NH2)2(s) + H2O(g)。
(1)在不同温度及不同y值下合成尿素,达到平衡时,氨气转化率变化情况如图所示。
①该反应的ΔH_____0(填“>” 或、“<” ),该反应自发进行的条件是_______________ (填“低温”“高温”或“任意温度”) 若y表示反应开始时的氨碳比[![]() ],则y1________y2。(填“>”、“<”或“=”);
],则y1________y2。(填“>”、“<”或“=”);
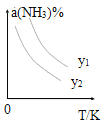
(2)t℃时,若向容积固定的密闭容器中加入一定量的 NH3和CO2合成尿素,下列叙述能说明此反应达到平衡状态的是________ (填字母)。
a.混合气体的平均相对分子质量保持不变
b.CO2和NH3的体积分数保持不变
c.CO2和NH3的转化率相等
d.混合气体的密度保持不变
e.1molCO2生成的同时有 2molN—H键断裂
II.工业上用CH4与水蒸气在一定条件下制取H2,:CH4(g) + H2O(g) ![]() CO(g) + 3H2(g) ΔH = + 203 kJmol-1
CO(g) + 3H2(g) ΔH = + 203 kJmol-1
①该反应逆反应速率表达式为:v逆=kc(CO) c3(H2),k 为速率常数,在某温度下测得实验数据如表:
CO浓度(molL-1) | H2浓度(molL-1) | 逆反应速率(molL-1min-1) |
0.05 | c1 | 4.8 |
c2 | c1 | 19.2 |
c2 | 0.1 | 8.1 |
由上述数据可得该温度下,该反应的逆反应速率常数k为____L3mol-3min-1。
②某温度下,在体积为3 L的密闭容器中通入物质的量均为3 mol的CH4和水蒸气,发生上述反应,5分钟时达到平衡,此时H2的体积分数为60%,则在5分钟内用CH4浓度变化表示的平均反应速率v(CH4)=________;该温度下该反应的平衡常数K=________。平衡后再向容器中加入1 mol CH4和1 mol CO,平衡_______移动(填“正反应方向”或“逆反应方向”或“不”)。
III.在常温下,将0.02mol CO2通入200mL 0.15mol/L的/span>NaOH溶液中,充分反应后下列关系式中正确的是_____________________
A.c(Na+)>c(HCO3-)> c(CO32-)>c(OH-)>c(H+)
B.3c (Na+)=2[c(CO32-)+ c(HCO3-)+ c(H2CO3)]
C.c (Na+)+c(H+)=c(HCO3-)+ c(CO32-)+c(OH-)
D.c(HCO3-)+ 3c(H2CO3)+2c(H+)= c(CO32-)+2c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
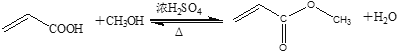
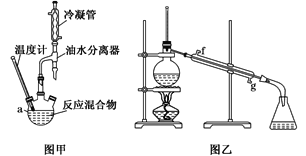
【题目】丙烯酸甲酯是一种重要的化工原料,实验室制备丙烯酸甲酯的反应、装置示意图和有关数据如下:
沸点(℃) | 溶解性 | 毒性 | |
丙烯酸 | 142 | 与水互溶,易溶于有机溶剂 | 有毒 |
甲醇 | 65 | 与水互溶,易溶于有机溶剂 | 有毒 |
丙烯酸甲酯 | 80.5 | 难溶于水,易溶于有机溶剂 | 无毒 |
实验步骤:
①向三颈瓶中加入10.0g丙烯酸、6.0g甲醇、数滴浓硫酸和几粒沸石,缓慢加热。
②反应30min后,停止加热,反应液冷却后,分别用少量水、饱和碳酸氢钠溶液和水洗涤。
③取上层油状液体,用少量无水MgSO4干燥后蒸馏,收集70~90℃馏分。
回答下列问题:
(1)反应过程采用水浴加热,原因是___。
(2)图甲中油水分离器的作用是___。
(3)判断酯化反应达到平衡的现象为__。
(4)第一次水洗的主要目的是___。
(5)在洗涤、分液步骤中用到的主要玻璃仪器有烧杯、___。
(6)图乙所示装置中冷却水的进口为___(填字母)。
为分析产率,进行如下实验:将收集到的馏分平均分成五份,取出一份置于锥形瓶中,加入2.5mol/LKOH溶液10.00mL,加热使之完全水解;用酚酞作指示剂,向冷却后的溶液中滴加0.5mol/LHCl溶液,中和过量的KOH,共消耗盐酸20.00mL。
(7)本次制备实验的产率为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知各种硝基苯酚的性质如下表:
名称 | 结构式 | 溶解度/(g/100 g水,25 ℃) | 熔点 /℃ | 沸点 /℃ |
邻硝基苯酚 |
| 0.2 | 45 | 100 |
间硝基苯酚 |
| 1.4 | 96 | 194 |
对硝基苯酚 |
| 1.7 | 114 | 295 |
下列关于各种硝基苯酚的叙述不正确的是( )
A.邻硝基苯酚分子内形成氢键,使其熔沸点低于另两种硝基苯酚
B.间硝基苯酚不仅分子间能形成氢键,也能与水分子形成氢键
C.对硝基苯酚分子间能形成氢键,使其熔沸点较高
D.三种硝基苯酚都不能与水分子形成氢键,所以在水中溶解度小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com