
| A. | 人造黄油 | B. | 人造棉花 | C. | 涤纶 | D. | 锦纶-66 |
 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源: 题型:选择题
| PH t/min T/℃ | 3.0 | 4.0 | 5.0 | 6.0 |
| 20 | 301 | 231 | 169 | 58 |
| 30 | 158 | 108 | 48 | 15 |
| 50 | 31 | 26 | 15 | 7 |
| A. | 实验表明,升高温度能加快O3的分解速率 | |
| B. | pH增大能加速O3分解,表明OH-可以对O3的分解起催化作用 | |
| C. | 在30℃、pH=4.0时,O3的分解速率为1.00×10-4mol/(L•min) | |
| D. | 据表中的规律可推知,O3在下列条件下的分解速率v(40℃、pH=3.0)>v(30℃、pH=7.0) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C3H4+5O2$\stackrel{点燃}{→}$3CO2+4H2O | |
| B. | Pb+PbO2+2H2SO4$?_{充电}^{放电}$2PbSO4+2H2O | |
| C. | CaCO3$\stackrel{高温}{→}$CaO+CO2↑ | |
| D. | mH2O+nCO2$→_{叶绿素}^{光}$Cm(H2O)m+nO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Ag(NH3)2NO3溶液中加入盐酸:Ag(NH3)2++2H+=Ag++2NH4+ | |
| B. | 磁性氧化铁(Fe3O4)溶于氢碘酸:Fe3O4+8H+=Fe2++2Fe3++4H2O | |
| C. | 向氯化铝溶液中加入过量氨水:Al3++4OH-=AlO2-+2H2O | |
| D. | 向Ca(HCO3)2溶液中加入澄清石灰水:Ca2++HCO3-+OH-=CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ,B是同周期第一电离能最小的元素,C的最外层有三个单电子,E的外围电子排布式为3d64s2.回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个单电子,E的外围电子排布式为3d64s2.回答下列问题: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,下列命名正确的是( )
,下列命名正确的是( )| A. | 2,3,4-三甲基己烷 | B. | 2,3-二甲基-4-乙基戊烷 | ||
| C. | 4-乙基-2,3-二甲基戊烷 | D. | 2-乙基-3,4-二甲基戊烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液态氟化氢中有三聚氟化氢(HF)3分子存在 | |
| B. | 冰的密度比液态水的密度小 | |
| C. | H2O的分解温度比H2S高 | |
| D. | 乙醇能与水以任意比混溶而甲醚(CH3-O-CH3)难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验方案 |  | 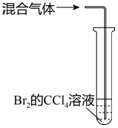 |  |  |
| 目的 | A.比较乙醇分子中羟基氢原子和水分子中氢原子的活泼性 | B.除去乙烯中的二氧化硫 | C.制银氨溶液 | D.证明碳酸酸性强于苯酚 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com