
| A. | 钠熔成光亮小球 | B. | 钠浮在水面上 | ||
| C. | 有气泡产生 | D. | 溶液质量分数为4.0% |
分析 钠的密度小于水,钠的熔点很低,钠和水反应生成氢氧化钠和氢气,且反应过程中放出大量热,发生反应:2Na+2H2O=2NaOH+H2↑,根据方程式计算氢氧化钠的物质的量,根据m=nM计算氢氧化钠的质量,然后求质量分数,据此分析解答.
解答 解:A.钠的密度小于水,所以钠会浮在水面上,钠的熔点较低,钠和水反应放出的热量使钠熔化成光亮银白色的小球,故A不选;
B.钠的密度小于水的密度,所以会浮在水面上,故B不选;
C.钠和水反应放出大量的热,且钠的熔点较低,使钠熔成小球,钠和水反应生成的氢气使小球到处游动,但在水的表面,所以无气泡,故C选;
D.0.1moL Na完全反应,则:
2Na+2 H2O=2 NaOH+H2↑
2 2 2g
0.1mol n 0.1g
n=0.1mol,m(NaOH )=0.1mol×40g/mol=4g
所以质量分数为:$\frac{4g}{2.3+97.8-0.1}$×100%=4.0%,故D不选;
故选C.
点评 本题考查钠的物理性质、钠与水反应的现象和化学方程式计算,比较基础,明确发生的反应即可解答,侧重对基础知识的巩固.


科目:高中化学 来源: 题型:解答题
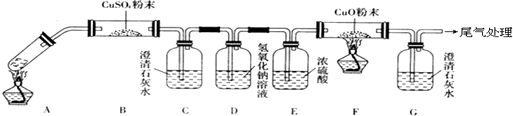
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 (苯胺,易被氧化)
(苯胺,易被氧化) ,其核磁共振氢谱图有4个吸收峰;
,其核磁共振氢谱图有4个吸收峰; ;
; ;
; 有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物共有6种;
有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物共有6种; 的流程:A$→_{Na/△}^{H_{2}}$甲→乙$\stackrel{Br_{2}/CCl_{4}}{→}$
的流程:A$→_{Na/△}^{H_{2}}$甲→乙$\stackrel{Br_{2}/CCl_{4}}{→}$ $→_{△}^{NaOH(aq)}$
$→_{△}^{NaOH(aq)}$
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
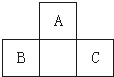 A、B、C均为短周期元素,它们在周期表中的位置如图.已知B、C元素的原子序数之和是A元素原子序数的4倍,则A、B、C所在的一组元素是( )
A、B、C均为短周期元素,它们在周期表中的位置如图.已知B、C元素的原子序数之和是A元素原子序数的4倍,则A、B、C所在的一组元素是( )| A. | Be、Na、Al | B. | B、Mg、Si | C. | C、Al、P | D. | O、P、Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题



查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2O2(l)=O2(g)+2H2O (l)△H=-196 kJ•mol-1 | |
| B. | 2N2(g)+O2(g)=2N2O(g)△H=+163 kJ•mol-1 | |
| C. | 2Ag(s)+Cl2(g)=2AgCl(s)△H=-254 kJ•mol-1 | |
| D. | 2HgO(s)=2Hg(l)+O2 (g)△H=+182kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2中混有HCl,将混合气体通入饱和的NaHCO3溶液中 | |
| B. | 从溴水中提取溴,用酒精萃取分液 | |
| C. | 用蒸馏的方法从酒精溶液中提取酒精 | |
| D. | 从较稀的KNO3溶液中得到KNO3晶体,可先对溶液进行蒸发浓缩、冷却结晶,再过滤 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com