
【题目】能正确表示下列反应的离子方程式是
A. 过氧化钠固体与水反应:2O22-+2H2O=4OH-+O2↑
B. 向明矾[KAl(SO4)2]溶液中逐滴加入Ba(OH)2溶液至SO42-恰好沉淀完全:2Al3++3SO42-+3Ba2++6OH- =2Al(OH)3↓+3BaSO4↓
C. 用铜做电极电解CuSO4溶液:2Cu2++2H2O![]() 2Cu+O2↑+4H+
2Cu+O2↑+4H+
D. FeSO4酸性溶液暴露在空气中:4Fe2++O2+4H+=4Fe3++2H2O
【答案】D
【解析】
A.过氧化钠在离子方程式中不能拆开,应该保留化学式;B.硫酸根离子恰好沉淀完全时,硫酸铝钾与氢氧化钡的物质的量之比为1:2,铝离子与氢氧根离子物质的量之比为1:4,二者恰好反应生成偏铝酸根离子;C.铜为电极,阳极放电的是金属铜,不是氢氧根离子,反应的实质为电解精炼铜;D.亚铁离子具有较强还原性,在溶液中容易被氧化成铁离子。
详解:A.过氧化钠固体与水反应生成氢氧化钠和氧气,过氧化钠不能拆开,正确的离子方程式为: 2Na2O2+2H2O=4Na++4OH-+O2↑,故A错误;
B.向明矾[KAl(SO4)2]溶液中逐滴加入Ba(OH)2溶液至SO42-恰好沉淀完全,铝离子完全反应生成偏铝酸根离子,正确的离子方程式为: Al3++2SO42-+2Ba2++4OH- =AlO2-↓+2BaSO4↓+2H2O,故B错误;
C.用铜做电极电解CuSO4溶液,阳极铜放电,电解的实质为电解精炼铜,故C错误;
D.硫酸亚铁酸性溶液暴露在空气中,亚铁离子容易被氧化成铁离子,反应的离子方程式为: 4Fe2++O2+4H+=4Fe3++2H2O,所以D选项是正确的;
所以D选项是正确的。


科目:高中化学 来源: 题型:
【题目】聚合物![]() (W是链接中的部分结构)是一类重要的功能高分子材料.聚合物是其中的一种,转化路线如下:
(W是链接中的部分结构)是一类重要的功能高分子材料.聚合物是其中的一种,转化路线如下:

已知:①A中官能团不在同一个碳原子上。
②![]()
③R1CH=CHR2+R3CH=CHR4![]() R1CH=CHR4+R2CH=CHR3(R表示烃基或氢原子)。
R1CH=CHR4+R2CH=CHR3(R表示烃基或氢原子)。
(1)B所含的官能团名称是__________。
(2)E的名称是__________,G生成H的反应类型是__________。
(3)写出D生成E的化学方程式是______________________。
(4)X的结构简式_______________。
(5)E存在多秧同分异构体,与E具有相同官能团且不能发生银镜反应的同分异构体有__________种(不考虑立体结构,不含E)。其中符合核磁共振氢谱中峰面积之比3:3:2 的结构简式________________________。
(6)以CH3CH2OH为原料(无机试剂任选)合成环丁烯,试写出合成流程图______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁的化合物有广泛用途,如碳酸亚铁(FeCO3)可作为补血剂,铁红(Fe2O3)可作为颜料。利用某硫酸厂产生的烧渣(主要含Fe2O3、FeO,还有一定量的SiO2)制备碳酸亚铁的流程如下:
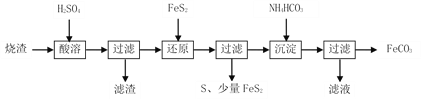
(1)“酸溶”时加快反应速率的方法有___________________(写出一种)。
(2)①“还原”时,FeS2与H2SO4不反应,Fe3+通过两个反应被还原,其中一个反应如下:FeS2 +14Fe3+ +8H2O=15Fe2++2SO42-+16H+,则另一个反应的离子方程式为:___________;
②FeS2还原后,检验Fe3+是否反应完全的方法是___________。
(3)①“沉淀”时,需控制pH不宜过高,否则生成的FeCO3中可能混有___杂质;
②写出加入NH4HCO3生成“沉淀”的化学方程式:___________________;
③所得FeCO3需充分洗涤,检验沉淀已洗涤干净的方法是_________________。
(4)FeCO3浊液长时间暴露在空气中,会有部分固体表面变为红褐色,同时释放出CO2,则与FeCO3反应的物质为_________(填化学式)。
(5)FeCO3在空气中煅烧生成Fe2O3时,也会生成FeO。现煅烧34.8g的FeCO3,得到Fe2O3和FeO的混合物23.76g。则Fe2O3的质量为______ g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质在水溶液中存在各种行为,如电离、水解、沉淀溶解等,据所学知识回答下列问题:
(1)t℃时,纯水中c(H+)=1×10-6 mol·L-1,则该温度下水的离子积常数KW=_______;该温度下,pH=10的Ba(OH)2溶液的物质的量浓度为_________。
(2)25℃时,相同物质的量浓度的下列溶液中:①NaCl ②NaOH ③H2SO4 ④(NH4)2SO4,其中水的电离程度由大到小顺序为______(用序号回答)。
(3)25℃时,将 a mol·L-1 的醋酸和 b mol·L-1 的氢氧化钠溶液等体积混合后,溶液的pH=7,则溶液中c(CH3COO-)+c(CH3COOH)=__________,则a_______ b(填“﹥”、“﹤”或“=”)。
(4)将AgCl分别放入:①5 mL水 ②10 mL 0.1 mol·L-1 MgCl2溶液 ③20 mL 0.5 mol·L-1 NaCl溶液 ④40 mL 0.3mol·L-1 盐酸溶液中溶解至溶液饱和,各溶液中Ag+的浓度分别为a、b、 c、d,它们由大到小的排列顺序是_____(用字母表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:常温下,Ksp(AgNO2)=2×10-8 mol2·L-2;Ksp(AgCl)=1.8×10-10 mol2·L-2。
(1)向2 mL 0.1 mol·L-1 NaNO2 溶液中滴加几滴稀硝酸银溶液,出现白色沉淀,再滴入0.5 mol·L-1 NaCl溶液,发生反应:AgNO2(s)+Cl-(aq)![]() AgCl(s)+NO2-(aq),则该反应的化学平衡常数K= 。
AgCl(s)+NO2-(aq),则该反应的化学平衡常数K= 。
(2)取物质的量浓度均为 0.1 mol·L-1 NaNO2、NaCl的混合溶液,逐滴加入AgNO3溶液(忽略体积改变)。当 AgNO2开始沉淀时,计算溶液中Cl-的物质的量浓度(写出必要的计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2.1g平均相对分子质量为7.2的CO与H2组成的混合气体与足量的O2充分燃烧后,立即通入足量的Na2O2固体中,固体的质量增加
A. 2.1g B. 3.6g C. 7.2g D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废弃物的综合利用既有利于节约资源,又有利于保护环境。实验室利用废弃旧电池的铜帽(Zn、Cu总含量约为99%)回收铜并制备ZnO的部分实验过程如下:
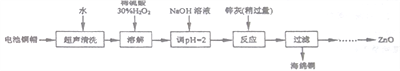
(1)①铜帽溶解时加入H2O2的目的是___________________(用化学方程式表示)。
②铜帽溶解后需将溶液中过量H2O2除去。除去H2O2的简便方法是_________________。
(2)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)含量,实验中需测定除去H2O2后溶液中Cu2+的含量。实验操作为:准确取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节pH=3~4,加入过量KI,用Na2S2O3标准溶液滴定至终点。上述过程中的离子方程式如下:2Cu2++4I-=2CuI(白色)↓+I2 I2+2S2O32-=2I-+S4O62-
①滴定选用的指示剂为_____________,滴定终点观察到的现象为_________________。
②若滴定前溶液中H2O2没有除尽,所测定的Cu2+的含量将会__________(填“偏高”“ 偏低”“ 不变”)。
(3)已知pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-。下表列出了几种离子生成氢氧化物沉淀pH(开始沉淀的pH按金属离子浓度为1.0mol·L-1计算)
开始沉淀的pH | 完全沉淀的pH | |
Fe3+ | 1.1 | 3.2 |
Fe 2+ | 5.8 | 8.8 |
Zn2+ | 5.9 | 8.9 |
实验中可选用的试剂:30%H2O2、1.0mol·L-1HNO3、1.0mol·L-1NaOH。
由除去铜的滤液制备ZnO的实验步骤依次为:
①向滤液中加入___________使其充分反应;②滴加1.0mol·L-1的氢氧化钠,调节3.2≤pH<5.9,使___________沉淀完全;③过滤;④向滤液中滴加1.0 mol·L-1的氢氧化钠,调节pH为________≤pH≤_______,使Zn2+沉淀完全,⑤过滤、洗涤、干燥;⑥900℃煅烧。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2O和CO是环境污染性气体,可在Pt2O+表面转化为无害气体,其反应为:N2O(g)+CO(g)![]() CO2(g)+N2(g)ΔH,有关化学反应的物质变化过程如图1,能量变化过程如图2。下列说法正确的是
CO2(g)+N2(g)ΔH,有关化学反应的物质变化过程如图1,能量变化过程如图2。下列说法正确的是
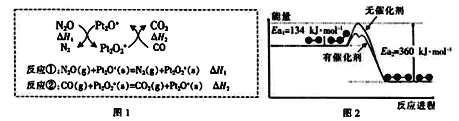
A. 由图1可知:ΔH1=ΔH+ΔH2
B. 由图2可知:ΔH=-226kJ/mol
C. 由图2可知:反应①的反应速率比反应②快
D. 为了实现转化需不断向反应器中补充Pt2O+和Pt2O2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10mL1 molL-1HCl溶液中滴加1 molL-1CH3COONa溶液,所得混合液的pH 与加入CH3COONa溶液的体积(V)的变化如图所示。下列说祛错误的是
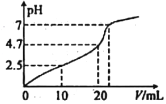
A. 常温下,CH3COOH 的电离常数Ka≈2.0×10-5
B. 随着V的增加,混合液中水的电离程度在不断增加
C. 当V=20 mL时,混合液中c(Na+)>c(Cl-)>c(CH3COO-)>c(H+)>c(OH-)
D. 当混合液的pH=7时,混合液中c(Cl-)=c(CH3COOH)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com