
| A. | C、Mg、Li | B. | Li、C、Mg | C. | C、Si、Mg | D. | C、O、Mg |
分析 X、Y、Z三种短周期元素,X原子的最外层电子数是次外层电子数的2倍,X应有2个电子层,最外层电子数为4,则X为C;Y原子的次外层电子数是最外层电子数的2倍,则Y若有2个电子层,为Li,若Y有3个电子层,最外层电子数为4,则Y为Si;Z原子的次外层电子数是最外层电子数的4倍,Z只能为第三周期元素,Z的最外层电子数为2,则Z为Mg,以此来解答.
解答 解:X、Y、Z三种短周期元素,X原子的最外层电子数是次外层电子数的2倍,X应有2个电子层,最外层电子数为4,则X为C;Y原子的次外层电子数是最外层电子数的2倍,则Y若有2个电子层,为Li,若Y有3个电子层,最外层电子数为4,则Y为Si;Z原子的次外层电子数是最外层电子数的4倍,Z只能为第三周期元素,Z的最外层电子数为2,则Z为Mg,
综上所述,X、Y、Z三种元素,可能为C、Li、Mg或C、Si、Mg,
故选C.
点评 本题考查原子结构与元素周期律,为高频考点,把握原子结构推断元素为解答的关键,侧重分析与应用能力的考查,注意均为短周期元素,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 3:1 | B. | 2:1 | C. | 4:1 | D. | 1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
| 粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5min |
| 块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30min |
| t/min | 0 | 20 | 40 | 60 | 80 |
| C(H2O2)/mol•L-1 | 0.80 | 0.40 | 0.20 | 0.10 | 0.05 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| N2+3H2?2NH3 | |||
| 起始浓度mol/L | 1.0 | 3.0 | 0 |
| 2秒末浓度mol/L | 0.6 | 1.8 | a |
| A. | 0.2mol/(L•s) | B. | 0.4mol/(L•s) | C. | 0.6mol/(L•s) | D. | 0.8mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
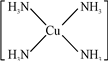 2+.
2+.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
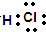 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com