
某原电池装置如右图所示,盐桥中装有用饱和氯化钾溶液浸泡过的琼脂。下列叙述正确的是
A.原电池工作一段时间后,FeCl2溶液中c(Cl-)会增大
B.此电池工作原理与硅太阳能电池工作原理相同
C.Fe为正极,石墨上发生的反应为:2H++2e-=H2↑
D.若装置中的盐桥用铁丝代替,电流表指针无偏转
科目:高中化学 来源: 题型:
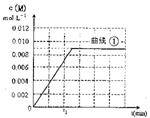
在10L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g) M(g)+N(g)
M(g)+N(g)
所得实验数据如下表:
| 实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
| n(X) | n(Y) | n(M) | ||
| ① | 700 | 0.40 | 0.10 | 0.090 |
| ② | 800 | 0.10 | 0.40 | 0.080 |
| ③ | 800 | 0.20 | 0.30 | a |
| ④ | 900 | 0.10 | 0.15 | b |
回答下列问题:
(1)实验①中,若5min时测得,n(M)=0.050mo1, 则0至5min时间内,用N表示的平均反应速率为________。
(2)实验③平衡常数为___________,该正反应为____________反应(填“吸热”或“放热”)
(3)能说明上述反应一定达到平衡的条件是_______________________。
A. c(Y)= c(N) B.平均分子量不再变化
C. v正(X) =v逆(M) D.温度和压强一定时,混合气体的密度不再变化
(4)实验③中,达到平衡时,X的转化率为_________________________。
(5)实验③、④中,达到平衡时,a与b的关系为__________(填选项),请解释原因________________。
A. a>2b B. a=2b C.b<a<2b D.a<b
(6)图是实验①中c(M)随时间变化的曲线图,请在图中画出实验②中c(M)随时间变化的曲线图。
查看答案和解析>>
科目:高中化学 来源: 题型:
测定有机化合物中碳和氢组成常用燃烧分析法,下图是德国化学家李比希测定烃类有机物组成的装置,氧化铜作催化剂,在750 ℃左右使有机物在氧气流中全部氧化为CO2和H2O,用含有固体氢氧化钠和高氯酸镁[Mg(ClO4)2]的吸收管分别吸收CO2和H2O。
试回答下列问题:
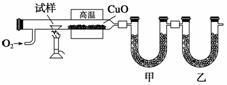
(1)甲装置中盛放的是__________,甲、乙中的吸收剂能否颠倒?说明理由:
________________________________________________________________________。
(2)实验开始时,要先通入氧气一会儿,然后再加热。为什么?
(3)若测得甲装置增重a g,乙装置增重b g,试求出烃中碳、氢原子个数比为________________。
(4)若已知试样是纯净物,某次测定时,测出碳、氢原子个数比为N(C)∶N(H)=11∶23,能否确定其为何种烃?________(填“能”或“不能”);若能,写出其分子式________(若不能,此空不必回答)。
查看答案和解析>>
科目:高中化学 来源: 题型:
偏二甲肼与N2O4 是常用的火箭推进剂,二者发生如下化学反应:
(CH3)2NNH2 (l )+2N2O4 (l )=2CO2 (g )+3N2 (g )+4H2O (l ) (Ⅰ)
(1)若将反应(Ⅰ)设计成原电池,则正极的电极反应式为
(酸性电解质)。
(2)火箭残骸中常现红棕色气体,原因为:N2O4 (g) 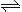 2NO2 (g) (Ⅱ)
2NO2 (g) (Ⅱ)
当温度升高时,气体颜色变深,则反应(Ⅱ)为 (填“吸热”或“放热”)反应。
(3)一定温度下,反应(Ⅱ)的焓变为ΔH。现将1 mol N2O4 充入一恒压密闭容器中,
下列示意图正确且能说明反应达到平衡状态的是________.
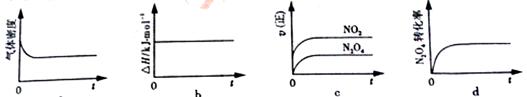
若在相同温度下,上述反应改在体积为1L的恒容密闭容器中进行,平衡常数________(填“增大”“不变”或“减小”),反应3s后NO2的物质的量为0.6mol,则0~3s内的平均反应速率v(N2O4)=________mol·L-1·s-1。
(4)NO2可用氨水吸收生成NH4NO3 。25℃时,将amol NH4NO3溶于水,溶液显酸性,原因是 (用离子方程式表示)。向该溶液滴加bL氨水后溶液呈中性,则滴加氨水的过程中的水的电离平衡将______(填“正向”“不”或
“逆向”)移动,所滴加氨水的浓度为_______mol·L-1。(NH3·H2O的电离平衡常数
Kb=2×10—5 mol·L-1)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关实验原理或操作正确的是

A.用图1装置验证在该条件下铁钉发生吸氧腐蚀
B.用湿润的蓝色石蕊试纸检验氨气
C.用20mL量筒量取15mL酒精,加水5mL,配制质量分数为75%酒精溶液
D.用图2装置检验实验室制得的乙烯中混有SO2和CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验、现象及相关结论均正确的是( )
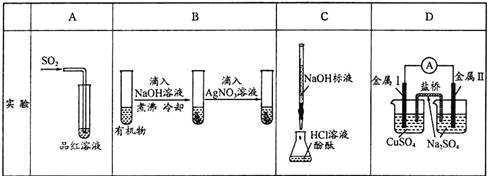
| 现象 | 品红褪色 | 最后试管有浅黄色沉淀 | 最后一滴溶液使酚酞由无色变为粉红色,且30秒不复原 | 盐桥左端从 无色逐渐变为 蓝色 |
| 结论 |
氧化性 | 有机物中含 有溴原子 | 滴定达到终点 | 金属II比I活泼 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式正确的是
A. 铝溶于NaOH溶液:Al+2OH—=AlO2—+H2↑
B. 铜溶于稀硝酸:3Cu+ 8H+ +2NO3—=3Cu2+ +2NO↑ + 4H2O
C. 碳酸镁中滴加稀盐酸:CO32—+2H+ =CO2↑ + H2O
D. 稀硫酸中滴加氢氧化钡溶液:H++ OH—=H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应中,改变反应物的用量或浓度,不会改变生成物的是( )
A.铜和硝酸反应
B.二氧化碳通入氢氧化钠溶液中
C.细铁丝在氯气中燃烧
D.氯化铝与氢氧化钠溶液反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com