
| A.2∶7 | B.1∶7 | C.7∶1 | D.5∶14 |
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 (x+y)Cu+xCO2+(x+2y+z)H2O
(x+y)Cu+xCO2+(x+2y+z)H2O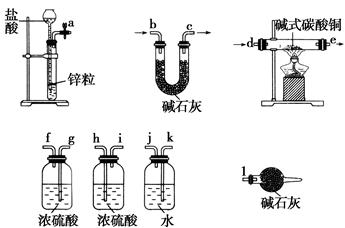
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.在反应后的溶液中滴加KSCN溶液,溶液呈红色 |
| B.反应后溶液中c(Cl-)=6mol/L |
| C.反应后溶液中加入铁屑不溶解 |
| D.反应后溶液中c(Cu2+): c(Fe2+)=1:1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 Cu2++Cu。由于反应温度不同,用氢气还原氧化铜时,可能产生Cu或Cu2O,两者都是红色固体。一同学对某次用氢气还原氧化铜实验所得的红色固体产物作了验证,实验操作和实验现象记录如下:
Cu2++Cu。由于反应温度不同,用氢气还原氧化铜时,可能产生Cu或Cu2O,两者都是红色固体。一同学对某次用氢气还原氧化铜实验所得的红色固体产物作了验证,实验操作和实验现象记录如下:| 加入 试剂 | 稀硫酸 | 浓硫酸、 加热 | 稀硝酸 | 浓硝酸 |
| 实验 现象 | 红色固体和 蓝色溶液 | 无色气体 | 无色气体和 蓝色溶液 | 红棕色气体 和蓝色溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题


查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
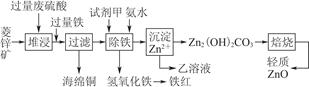
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 6.3 | 9.7 |
| Fe3+ | 1.5 | 3.2 |
| Zn2+ | 6.2 | 8.0 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.3︰1 | B.1︰2 | C.2︰1 | D.1∶1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com