
| A. | 恒温缩小体积,平衡向右移动,再次达平衡时颜色比原平衡浅 | |
| B. | 恒容升温,逆反应速率加快,正反应速率减慢 | |
| C. | 若改变条件使平衡向右移动,则该反应的平衡常数将增大 | |
| D. | 恒温恒容,充入少量NO2,再次达平衡时NO2的转化率比原平衡的大 |
分析 A、缩小体积,各种物质的浓度均增大,所以颜色加深;
B、升高温度,正逆反应速率均加快;
C、如果不是温度影响导致平衡移动,则平衡常数不变;
D、体积不变,加入少许NO2,平衡向正反应移动.
解答 解:A、缩小体积,各种物质的浓度均增大,所以颜色加深,故A错误;
B、升高温度,正逆反应速率均加快,故B错误;
C、如果不是温度影响导致平衡移动,则平衡常数不变,所以平衡向右移动,则该反应的平衡常数不一定变化,故C错误;
D、恒温恒容,再充入少量NO2,相当于加压效果,所以达到新平衡时NO2的转化率比原平衡的大,故D正确,
故选D.
点评 本题主要考查的是化学反应平衡的影响因素,涉及压强、浓度、温度等的影响,难度不大.


 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:选择题
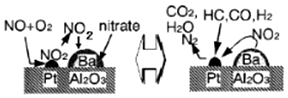
| A. | 该机理研究的是汽车尾气催化转化机理 | |
| B. | CO在催化剂表面被还原生成CO2,铂起催化作用 | |
| C. | CO在催化剂表面可能和O2、NO反应 | |
| D. | NO、CO均能与人体中的血红蛋白结合 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
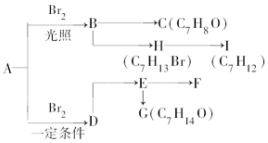 A是分子式为C7H8的芳香烃,已知它存在以下一系列转化关系,其中C是一种一元醇,D是A的对位一取代物,H与E、I与F分别互为同分异构体:
A是分子式为C7H8的芳香烃,已知它存在以下一系列转化关系,其中C是一种一元醇,D是A的对位一取代物,H与E、I与F分别互为同分异构体: ,
, .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | n(CO2)=0.1时,c(Na+)>c(AlO2-)>c(CO32-)>c(OH-) | |
| B. | 0.1mol<n(CO2)<0.15时发生的反应是:Na2CO3+CO2+H2O═2NaHCO3 | |
| C. | n(CO2)=0.15时,c(Na+)>c(CO32-)>c(HCO3-)>c(OH-) | |
| D. | n(CO2)=0.3时,c(Na+)>c(HCO3-)>c(OH-)>c(CO32-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 醋酸溶液与氨水混合:CH3COOH+NH3•H2O═CH3COO-+NH4++H2O | |
| B. | 铜片插入硝酸银溶液中:Cu+Ag+═Cu2++Ag | |
| C. | 常温下C12与NaOH溶液反应:Cl2+2OH-═C1-+C1O-+H2O | |
| D. | 氢氧化钡溶液中加入稀硫酸:Ba2++SO42-═BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
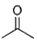 根据键线式回答下列问题:
根据键线式回答下列问题: 分子式:C5H9O2,结构简式:CH2=C(CH3)COOCH3
分子式:C5H9O2,结构简式:CH2=C(CH3)COOCH3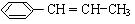 )在催化剂作用下生成聚苯丙烯的反应方程式:
)在催化剂作用下生成聚苯丙烯的反应方程式:
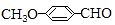 有多种的同分异构体,其中属于芳香族羧酸的同分异构体共有4种,它们的结构简式是:
有多种的同分异构体,其中属于芳香族羧酸的同分异构体共有4种,它们的结构简式是: ;
; ;
; ,
, (任意一种);、(任写其中一种)
(任意一种);、(任写其中一种)查看答案和解析>>
科目:高中化学 来源: 题型:填空题
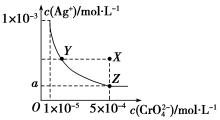 图是铬酸银(Ag2CrO4)T℃时,在水溶液中的沉淀溶解平衡曲线.
图是铬酸银(Ag2CrO4)T℃时,在水溶液中的沉淀溶解平衡曲线.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.6mol/L | B. | 3.2mol/L | C. | 2.8mol/L | D. | 2.4mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com