
【题目】将晶体X加热分解,可得A、B、D、E、F和水六种产物,其中A、B、D都是中学化学中常见的氧化物,气体E是单质F所含元素的氢化物。
(1)E能使湿润的红色石蕊试纸变蓝,实验室制取E气体的化学方程式为_____________,制得的气体可用如图所示装置收集,则气体应从______(填“A”或“B”)通入。
![]()
(2)A能溶于强酸、强碱,写出A与强碱溶液反应的离子方程式_______________。
(3)B、D都是酸性氧化物且组成元素相同,D溶于水得强酸,则B、D分子中除氧元素外所含另一种元素在周期表中的位置是__________________________。
(4)由各分解产物的物质的量之比推测X的组成类似于明矾,若向X的浓溶液中滴加浓NaOH溶液至过量,现象依次为__________________________________。
(5)取一定量的X晶体分解,若生成1 mol F,则必同时生成_______________ (填化学式)。
【答案】 Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+2H2O B Al2O3+2OH-==2AlO2-+H2O 第三周期第VIA族 生成白色沉淀,生成有刺激性气味的气体,白色沉淀又逐渐溶解 SO2
CaCl2+2NH3↑+2H2O B Al2O3+2OH-==2AlO2-+H2O 第三周期第VIA族 生成白色沉淀,生成有刺激性气味的气体,白色沉淀又逐渐溶解 SO2
【解析】⑴. E能使湿润的红色石蕊试纸变蓝,则E为NH3,实验室制备氨气的方程式为:Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+2H2O,由于氨气的密度比空气小,应用向下排空气法收集,故应从B管通入气体收集,故答案为:Ca(OH)2+2NH4Cl
CaCl2+2NH3↑+2H2O,由于氨气的密度比空气小,应用向下排空气法收集,故应从B管通入气体收集,故答案为:Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+2H2O;B;
CaCl2+2NH3↑+2H2O;B;
⑵. 既能溶于强酸又能溶于强碱的常见氧化物A为Al2O3,与强碱溶液反应的离子方程式为:Al2O3+2OH-==2AlO2-+H2O,故答案为:Al2O3+2OH-==2AlO2-+H2O;
⑶. 由B、D都是酸性氧化物且组成元素相同,D溶于水得强酸,可知D为SO3,B为SO2,二者都含有的另一种元素是硫元素,在周期表中的位置是第三周期第ⅥA族,故答案为:第三周期ⅥA族;
⑷. 根据以上分析可知,X中含有铝离子、铵根离子、硫酸根离子,再结合X的组成类似于明矾,可知其化学式为:NH4Al(SO4)212H2O,NH4Al(SO4)212H2O的溶液中含有铵根离子和铝离子,加入氢氧化钠溶液后,铝离子先与氢氧根离子反应生成氢氧化铝白色沉淀,铝离子反应完全后铵根离子与氢氧根离子反应生成氨气,最后白色沉淀氢氧化铝会逐渐溶解,
故答案为:生成白色沉淀,生成刺激性气味的气体,白色沉淀又逐渐溶解;
⑸. F单质的氢化物是氨气,则F是氮气,因为A是氧化铝、B是二氧化硫、D是三氧化硫、E是氨气、F是氮气,根据产物可知,X分解生成SO2和N2时发生了元素化合价变化,因此答案是:SO2。


科目:高中化学 来源: 题型:
【题目】下列有关Na2CO3和NaHCO3的说法不正确的是( )
A.等质量的Na2CO3和NaHCO3分别与足量盐酸反应,NaHCO3产生的CO2多
B.等物质的量的盐酸分别与足量的Na2CO3和NaHCO3反应,Na2CO3产生的CO2多
C.相同温度在水中的溶解度:Na2CO3大于NaHCO3
D.等物质的量的Na2CO3和NaHCO3分别与足量的盐酸反应,消耗盐酸的量一样多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将几滴KSCN(SCN-是“类似卤离子”)溶液加入到酸性的含有Fe3+的溶液中,溶液变为红色,将该红色溶液分为两份:①向其中—份溶液中加入适量KMnO4溶液,红色褪去;②向另一份溶液中通入SO2,红色也褪去。下列说法中不正确的是
A. ①中红色褪去的原因是KMnO4将SCN-氧化,使Fe(SCN)3消失
B. ②中红色褪色的原因是SO2将Fe3+还原为Fe2+
C. ②中红色裡色的原因是SO2将SCN-还原
D. SCN-在适当条件下可失去电子被氧化剂氧化为(SCN)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
A.在同温同压时,相同体积的任何气体单质所含的原子数目相同
B.常温常压下,32g氧气(O2)和32g臭氧(O3)都含有2NA个氧原子
C.500mL 0.2 mol/L Na2SO4溶液中含有NA个Na+离子
D.通常状况下,22.4 L的氨气和甲烷含有的电子数均为10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出的有关物质的性质与用途具有对应关系的是
选项 | 物质的性质 | 用途 |
A | MgO难溶于水 | 耐火材料 |
B | SO2具有强的还原性 | 漂白纸张 |
C | CuSO4易溶于水 | 游冰池杀菌消毒 |
D | NaHCO3能与酸反应 | 治疗胃酸过多 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,根据表中给出的10种元素,用化学用语回答下列问题。
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | C | N | O | Ne | ||||
3 | Na | Mg | Al | Si | S | Cl |
(1)空气中含量最多的气体是____________;
(2)化学性质最不活泼的单质是 _________;
(3)Mg的原子结构示意图为_____________;
(4)C与O中,原子半径较小的是________ ;
(5)常用于制造光导纤维的是___________
(6)组成物质种类最多的元素是_________;
(7)H2S和H2O中,热稳定性较弱的是_________;
(8)元素最高价氧化物对应的水化物中,酸性最强的是_________
(9)钠的两种氧化物,分别是_________ 和 __________;
(10)写出铝的氧化物与氢氧化钠溶液反应的化学方程式___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以Al(OH)3、H2SO4、工业硝酸铵(含FeSO4)为原料制备透明氧化铝陶瓷的工艺流程如下:
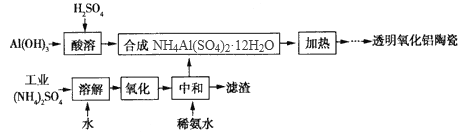
回答下列问题:
(1)氧化步骤中需加入稍过量的氧化剂,下列物质中最合适的是_____。
a. NaClO b.H2O2 c. KMnO4 d.K2Cr2O7
(2)选用上述氧化剂之后,需取少量溶液检验Fe2+是否己全部被氧化,所加试剂为_____(写名称)。
(3)如何检验中和液中的杂质离子己完全除尽?______________________________。
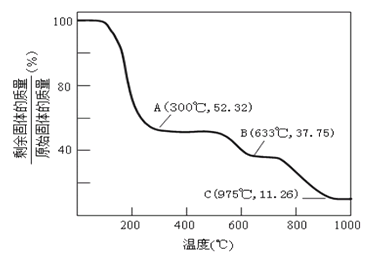
(4) 固体NH4Al(SO4)2·12H2O(相对分子质量453)在加热时,固体残留率隨温度的变化如图所示。由300℃加热至633℃时发生反应的化学方程式为_________________________________;(已知该反应为非氧化还原反应)975℃剩余固体成分的化学式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子可能大量共存的是( )
A. 与铝反应放出氢气的溶液中:Na+、Cl-、S2-、SO32-
B. 常温下Kw/c(H+)=1×10-13mol·L-1的溶液中:Ca2+、Fe2+、NO3-、NH4+
C. 常温下水电离出的c(H+)=10-10mol·L-1的溶液中Na+、K+、Cl-、HCO3-
D. 0.5 mol·L-1AlCl3溶液中:AlO2-、K+、CO32-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com