
| A. | 盐酸中滴加氨水:H++OH-═H2O | |
| B. | 用FeCl3溶液腐蚀铜线路板:Cu+Fe3+═Cu2++Fe2+ | |
| C. | 铜溶于稀硝酸:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O | |
| D. | 将氯气溶于水制备次氯酸:Cl2+H2O═2H++Cl-+ClO- |
分析 A.一水合氨在离子反应中保留化学式;
B.电子、电荷不守恒;
C.反应生成硝酸铜、NO和水;
D.反应生成盐酸和HClO,HClO在离子反应中保留化学式.
解答 解:A.盐酸中滴加氨水的离子反应为H++NH3.H2O═H2O+NH4+,故A错误;
B.用FeCl3溶液腐蚀铜线路板的离子反应为Cu+2Fe3+═Cu2++2Fe2+,故B错误;
C.铜溶于稀硝酸的离子反应为3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,故C正确;
D.将氯气溶于水制备次氯酸的离子反应为Cl2+H2O═H++Cl-+HClO,故D错误;
故选C.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重氧化还原反应、复分解反应的离子反应考查,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硝酸 | B. | 无水乙醇 | C. | 石灰水 | D. | 盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可以用分液漏斗分离硝基苯和苯 | |
| B. | 加浓溴水,然后过滤可以除去苯中少量乙烯 | |
| C. | 苯、溴水、铁粉混合制得溴苯 | |
| D. | 用溴水可以鉴别苯、乙醇、苯乙烯( ) ) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
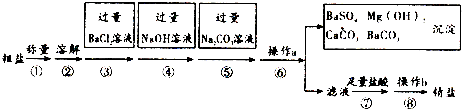
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | 氢化物的沸点为H2T<H2R | B. | 单质与稀盐酸反应的速率为L<Q | ||
| C. | M与T、Q与 T形成的化合物性质相似 | D. | L2+与R2-的核外电子数相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com