
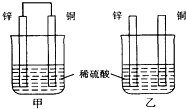
| A. | 两烧杯中铜片表面均无气泡产生 | B. | 甲中铜片是正极,乙中铜片是负极 | ||
| C. | 两烧杯中溶液的氢离子浓度均减小 | D. | 产生气泡的速度甲比乙慢 |
分析 甲中形成铜锌原电池,锌作负极,失电子,铜作正极,H+在铜极上得电子,生成H2,总反应式为:Zn+H2SO4=ZnSO4+H2↑.乙装置中只是锌片与稀硫酸间发生了置换反应:Zn+H2SO4=ZnSO4+H2↑,以此进行分析.
解答 解:A.甲中形成铜锌原电池,锌作负极,失电子,铜作正极,H+在铜极上得电子,生成H2,所以甲中铜片表面有气泡产生,故A错误;
B.甲中铜为正极,乙中不构成原电池,铜片不是电极,B错误;
C.甲中铜片上氢离子得电子生成氢气,乙中锌和稀硫酸发生置换反应生成氢气,所以两烧杯的溶液中氢离子浓度均减小,故C正确;
D.甲能形成原电池,乙不能构成原电池,所以产生气泡的速度甲比乙快,故D错误;
故选C.
点评 本题考查了置换反应和原电池的有关知识,题目难度不大,注意把握原电池的组成条件的工作原理.


 学业测评一课一测系列答案
学业测评一课一测系列答案科目:高中化学 来源: 题型:选择题
| A. | SO2和C(金刚石) | B. | CO2和H2 | C. | NaCl和HCl | D. | MgCl2和KCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
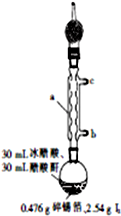 四碘化锡(SnI4)是一种橙红色结晶,熔点为144.5℃,沸点为364℃,不溶于冷水,溶于醇、苯、氯仿等,遇水易水解,常用作分析试剂和有机合成试剂.实验室制备四碘化锡的主要步骤如下:
四碘化锡(SnI4)是一种橙红色结晶,熔点为144.5℃,沸点为364℃,不溶于冷水,溶于醇、苯、氯仿等,遇水易水解,常用作分析试剂和有机合成试剂.实验室制备四碘化锡的主要步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
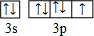 ,R基态原子的外围电子排布式为3d104s1.
,R基态原子的外围电子排布式为3d104s1.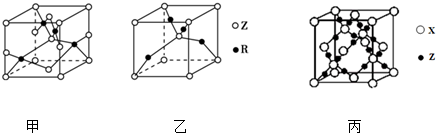
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4 molA+2 molB | |
| B. | 4 mol C+1 molD+2mol A+1 mol B | |
| C. | 1.6mol C+0.3 molD+1.2mol A+0.6 mol B | |
| D. | 4 mol C+0.8molD |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com