
分析 (1)根据标准状况下的气体摩尔体积计算出气体的物质的量,再根据反应方程式中化学计量数关系计算出29.6g M(NO3)2的物质的量,根据M=$\frac{m}{n}$计算出摩尔质量,最后计算M的摩尔质量;
(2)设10%NaOH溶液的质量为m,根据溶质质量不变列方程计算溶液的质量,进而计算溶质的物质的量,根据c=$\frac{n}{V}$计算;
(3)根据M=ρVm计算混合气体的平均摩尔质量,令CH4和CO的物质的量分别为xmol、ymol,根据平均摩尔质量列方程计算CH4和CO的物质的量之比,再计算出甲烷的体积分数.
解答 解:(1)在标准状况下收集11200mL的气体体积为11.2L,物质的量为:$\frac{11.2L}{22.4L/mol}$=0.5mol,
根据反应方程式2M(NO3)2$\frac{\underline{\;\;△\;\;}}{\;}$2MO+4NO2↑+O2↑可知:
2 4 1
硝酸盐的物质的量为:0.5mol×$\frac{2}{4+1}$=0.2mol,
M(NO3)2的摩尔质量为:$\frac{29.6g}{0.2mol}$=148g/mol,
摩尔质量在以g/mol为单位时,在数值上与相对分子量或相对原子量相等,所以M(NO3)2的式量为:148,M的相对原子量为:148-62×2=24,
所以M的摩尔质量为:24g/mol,
故答案为:24g/mol;
(2)设10%NaOH溶液的质量为m,则:
m×10%=(m-100g)×20%,
解得m=200g,
m(NaOH)=200g×10%=20g,
n(NaOH)=$\frac{20g}{40g/mol}$=0.5mol,
c(NaOH)=$\frac{0.5mol}{0.08L}$=6.25mol/L,
故答案为:6.25;
(3)混合气体的平均摩尔质量为:0.848g/L×22.4L/mol=19g/mol,则混合气体的平均相对分子质量为19;
设CH4和CO的物质的量分别为xmol、ymol,则:$\frac{16x+28y}{x+y}$=19,整理得:x:y=3:1,
所以混合气体中甲烷的体积分数为:$\frac{3}{1+3}$×100%=75%,
故答案为:19;75%.
点评 本题考查了化学方程式的计算、物质的量浓度的计算等知识,题目难度中等,试题知识点较多、计算量较大,明确物质的量与摩尔质量等物理量之间的关系为解答关键,试题充分考查了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | C60H120O60 | B. | C60H100O52 | C. | C60H102O51 | D. | C60H112O51 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
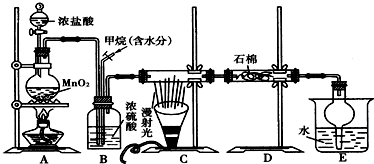
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
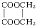 +2H2O,反应类型是酯化反应.
+2H2O,反应类型是酯化反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3=2 FeO42-+3Cl-+H2O+4H+ | |
| B. | 碳酸氢铵溶液与足量氢氧化钠溶液反应:NH4++OH-=NH3•H2O | |
| C. | NaHSO4溶液中滴入Ba(OH)2溶液至中性:H++SO42-+Ba2+十OH-═BaSO4↓+H2O | |
| D. | 把少量碳酸氢钠溶液加入到氢氧化钡溶液中:HCO3-+Ba2++OH-=BaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
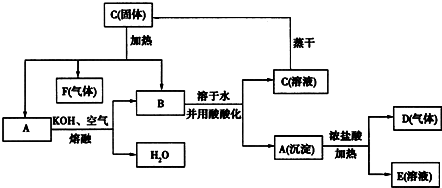
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
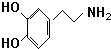
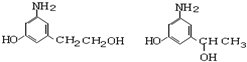 .
.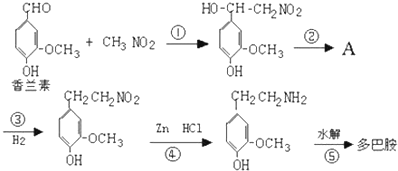
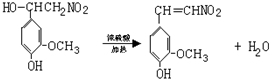 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 砷元素的最高化合价为+3 | |
| B. | 砷的气态氢化物比NH3稳定 | |
| C. | 砷的最高价氧化物的水溶液呈强碱性 | |
| D. | 砷原子的第3电子层含有18个电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com