
【题目】取来两份等浓度的NaOH溶液A和B,每份10mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.2mol/L的盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如图所示,试回答下列问题:
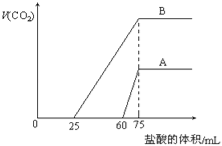
(1)原NaOH溶液的物质的量浓度为 mol/L.
(2)曲线A表明,原NaOH溶液中通入CO2后,所得溶液中的溶质为(写化学式) ;其物质的量之比为 .
(3)曲线B表明,原NaOH溶液中通入CO2后,所得溶液加盐酸产生CO2气体体积(标准状况)的最大值为 mL.
【答案】(1)0.9 (2)NaOH Na2CO3; 4:1 (3) 134.4
【解析】
试题(1)加入90ml盐酸时二氧化碳的体积最大,此时溶液为氯化钠溶液.根据氯离子、钠离子守恒,所以n(NaOH)=n(NaCl)=n(HCl)=0.09ml×0.1mol/L=0.009mol,则c(NaOH)=0.009/0.01=0.9mol/L;
(2)CO2与NaOH反应为①CO2+NaOH=NaHCO3,②CO2+2NaOH=Na2CO3+H20,
当n(CO2):n(NaOH)≥1,反应按①进行,等于1时,CO2、NaOH恰好反应生成NaHCO3;大于1时,生成生成NaHCO3,CO2有剩余;当0.5<n(CO2)/n(NaOH)<1,反应按①②进行,CO2、NaOH反应,无剩余,生成物为NaHCO3、Na2CO3;当n(CO2)/n(NaOH)≤0.5,反应按②进行,等于0.5时,CO2、NaOH恰好反应生成Na2CO3;小于0.5时,生成Na2CO3,NaOH有剩余;由曲线A可知从75ml到90ml为碳酸氢钠与盐酸反应,反应方程式为NaHCO3+HCl=NaCl+CO2↑+H2O,所以n(NaHCO3)=n(HCl)=(90ml-75ml)×0.1mol/L=1.5×10-3mol,
根据C原子守恒,所以n(CO2)=n(NaHCO3)=1.5×10-3mol,由(1)可知,n(NaOH)=0.009mol,
所以n(CO2)/n(NaOH) =1/6,小于0.5,所以反应按②进行,NaOH有剩余,溶液中溶质为Na2CO3和NaOH.根据C原子守恒,所以n(Na2CO3)=n(CO2)=1.5×10-3mol,再根据钠离子守恒,得溶液中氢氧化钠的物质的量为0.009mol-1.5×10-3mol×2=0.006mol,所以溶液中NaOH与Na2CO3的物质的量之比为0.006mol:1.5×10-3mol=4:1;
(3)由曲线B可知从30ml到90ml为碳酸氢钠与盐酸反应生成二氧化碳,反应方程式为NaHCO3+HCl=NaCl+CO2↑+H2O,所以n(CO2)=n(HCl)=(90ml-30ml)×0.1mol/L=0.006mol,
所以CO2气体体积为0.006mol×22.4L/mol=0.1344L=134.4ml。


 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:
【题目】如图所示的图解表示构成细胞的元素、化合物,a、b、c、d代表不同的小分子物质,A、B、E、F代表不同的大分子物质,请分析回答下列问题:
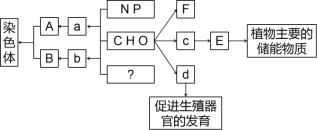
(1)在动物细胞内,与物质E作用最相近的物质是__________,若F为植物细胞细胞壁的主要成分,则它的合成主要发生在有丝分裂的________期。
(2)物质d和__________、胆固醇都属于固醇类物质。
(3)?处的元素为________,由多个b连接形成B的过程被称为_____________。
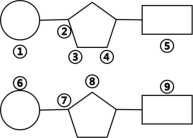
(4)下图为染色体结构中的一部分,若想将以下两个小分子以化学键连接起来,则连接的两点为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对一些实验事实的理论解释正确的是( )
选项 | 实验事实 | 理论解释 |
A | 氮原子的第一电离能大于氧原子 | 氮原子2p能级半充满 |
B | CO2为直线形分子 | CO2分子中 |
C | 金刚石的熔点低于石墨 | 金刚石是分子晶体,石墨是原子晶体 |
D | HF的沸点高于HCl | HF的相对分子质量小于HCl |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法完全正确的是( )
A.放热反应均是自发反应
B.如果ΔH和ΔS 均为正值,当温度升高时,反应可能自发进行
C.ΔS为正值的反应均是自发反应
D.物质的量增加的反应,ΔS为正值
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯酸钾和浓盐酸之间有下列反应:
![]() KClO3 +
KClO3 + ![]() HCl(浓)==
HCl(浓)== ![]() KCl +
KCl + ![]() Cl2↑+
Cl2↑+ ![]() ClO2 +
ClO2 + ![]() H2O。
H2O。
(1)配平上述方程式_____________________。
(2)该反应氧化剂是__________,氧化产物是___________。
(3)当有0.4mol电子发生转移时,生成的氯气的体积为_____L(标准状况)。被氧化的HCl的物质的量为____mol。
(4)若分别用①KMnO4(还原产物是Mn2+)②MnO2(还原产物是Mn2+)③Ca(ClO)2(还原产物是Cl2)与浓盐酸反应制备氯气,当浓盐酸足量且这三种氧化剂的物质的量相同时,生成氯气的物质的量最少的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】福酚美克是一种影响机体免疫力功能的药物,可通过以下方法合成:

(1)福酚美克中的含氧官能团有_______和_______(填名称)。
(2)C→D的转化属于_______反应(填反应类型)。
(3)上述流程中设计A→B步骤的目的是_________________________________。
(4)A与足量氢氧化钠溶液反应的方程式为:_________________________________。
(5)A的同分异构体X满足下列条件:
Ⅰ.能与NaHCO3反应放出气体;
Ⅱ.能与FeCl3溶液发生显色反应。
符合上述条件的同分异构体有______种。其中核磁共振氢谱有5组吸收峰的结构简式为______________。
(6)参照上述合成路线和信息,以乙醛为原料(无机试剂任选),设计制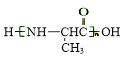 的合成路线:____________________________。
的合成路线:____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、R为前四周期原子序数依次增大的元素。X原子有3个能级,且每个能级上的电子数相等;Z原子的不成对电子数在同周期中最多,且Z的气态氢化物在同主族元素的氢化物中沸点最低;X、Y、R三元素在周期表中同族。
(1)R元素在周期表中的位置是_______________________,其基态原子的价层电子排布图为__________________________。
(2)下图表示X、Y、Z的四级电离能变化趋势,其中表示Z的曲线是_________(填标号)。

(3)化合物(XH2=X=O)分子中X原子杂化轨道类型是___________,1mol (X2H5O)3Z=O分子中含有的σ键与π键的数目比为_______________。
(4)Z与氯气反应可生成一种各原子均满足8电子稳定结构的化合物,其分子的空间构型为______。
(5)某R的氧化物晶胞结构如下图所示,该物质的化学式为____________。已知该晶体密度为ρg/cm3,距离最近的两个原子的距离为d pm,则R的相对原子质量为___________________。 (阿伏加德罗常数为NA)

(6)X形成的一种常见单质,性质硬而脆,原因是____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com