
下列关系式中,正确的是
A.等浓度等体积的CH3COOH和CH3COONa溶液混合:c(CH3COO- )+c(OH -)=c(H+)+c(CH3COOH)
B.常温下,0.1 mol·L-1 HA溶液与0.1 mol/LNaOH溶液等体积完全反应时,溶液中一定存在:c(Na+)=c(A- )>c(OH )=c(H+)
C.常温下,0.1 mol·L-1 Na2S溶液中存在:c(OH- )=c(H+)+c(HS- )+c(H2S)
D.常温下,将0.1 mol·L-1 CH3COOH溶液加水稀释,当溶液的pH从3.0升到5.0时,溶液中c(CHCOO-)/c(CHCOOH)的值增大到原来的100倍
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2015-2016学年吉林省高二上学期期中(文)化学试卷(解析版) 题型:填空题
请把下列物质按类别填空:
A Na2O B K2SO4 C NaHCO3 D 镁铝合金
E Na F CaO G CaCO3 H Ca(OH)2
(1)属于盐的是________________________________;
(2)属于碱的是________________________________;
(3)属于单质的是________________________________;
(4)属于氧化物的是________________________________。
查看答案和解析>>
科目:高中化学 来源:2016届浙江省富阳市高三上学期第二次质检化学试卷(解析版) 题型:选择题
已知某溶液中含有下列8种离子中的5种(忽略水的电离及离子的水解):K+、Cu2+、Al3+、Fe2+、Cl-、CO32-、NO3-、SO42-,且5种离子的物质的量浓度相等。为了进一步探究该水溶液的组成,某同学进行了如下实验:
①用铂丝蘸取少量溶液,在火焰上灼烧,透过蓝色钴玻璃观察无紫色火焰。
②另取溶液加入足量盐酸,有无色气体生成,该无色气体遇空气变成红棕色。
③另取溶液加入BaCl2溶液,有白色沉淀生成。
根据上述实验,以下推测正确的是
A.无法确定溶液中是否存在Cu2+离子
B.原溶液中不含K+、Al3+、CO32-等离子
C.根据步骤②只能确定溶液中一定存在NO3-离子
D.步骤③所得到的白色沉淀共有2种钡盐
查看答案和解析>>
科目:高中化学 来源:2016届浙江省高三上学期月考(三)化学试卷(解析版) 题型:选择题
下列有关实验装置进行的相应实验,能达到实验目的的是( )
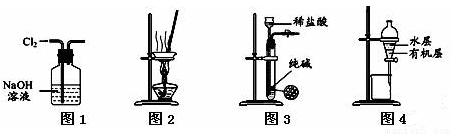
A.用图1所示装置除去Cl2中含有的少量HCl
B.用图2所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体
C.用图3所示装置制取少量纯净的CO2气体
D.用图4所示装置分离CCl4萃取碘水后已分层的有机层和水层
查看答案和解析>>
科目:高中化学 来源:2016届山东师大附中高三上学期第二次模拟考试化学试卷(解析版) 题型:选择题
设NA是阿伏加德罗常数的数值。下列说法正确的是( )
A.分子数为NA的CO、N2混合气体的质量为28g
B.0.1mol氧气作为氧化剂得到电子的数目一定为0.4NA
C.22.4L氯气和氮气的混合气体含有2NA个原子
D.0.1mol·L-1的氢氧化钠溶液含有0.1NA个OH-
查看答案和解析>>
科目:高中化学 来源:2016届山东省高三12月月考化学试卷(解析版) 题型:选择题
单质或化合物A可能为Na、C 、Si、 N2 、H2S,可以实现下列转化关系的有( )
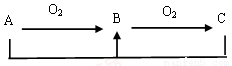
A.2种 B.3种 C.4种 D.5种
查看答案和解析>>
科目:高中化学 来源:2016届山东省济宁市高三上学期期中考试化学试卷(解析版) 题型:选择题
设NA代表阿伏伽德罗常数的数值,下列说法正确的是( )
A.1mol硫酸铝钾中阴离子所带电荷数为2NA
B.标准状况下,NA个SO3分子所占的体积约为22.4L
C.将0.1mol氯化铁溶于1L水中,所得溶液含有0.1NAFe3+
D.标准状况下,22.4L Cl2与足量氢氧化钠溶液反应转移的电子数为NA
查看答案和解析>>
科目:高中化学 来源:2016届江苏省淮安市高三上学期10月阶段测化学试卷(解析版) 题型:实验题
二氧化氯(ClO2黄绿色易溶于水的气体)是高效、低毒的消毒剂,回答下列问题:
(1)工业上可用KC1O3与Na2SO3在H2SO4存在下制得ClO2,该反应氧化剂与还原剂物质的量之比为 。
(2)实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过以下过程制各ClO2:


己知:NCl3中Cl元素化合价为+1价,具有强氧化性
①电解时发生反应的化学方程式为 。
②溶液X中大量存在的阴离子有 。
③除去ClO2中的NH3可选用的试剂是 (填标号)。
A、水 B、碱石灰 C、浓硫酸 D、饱和食盐水
(3)用下图装置可以测定混合气中ClO2的含量:
I、在锥形瓶中加入足量的碘化钾,用50mL水溶解后,再加入3mL稀硫酸;
II、在玻璃液封装置中加入水,使液面没过玻璃液封管的管口;
III、.将一定量的混合气体通入锥形瓶中吸收;
IV、将玻璃液封装置中的水倒入锥形瓶中;
V、用0.1000 mol·L-1硫代硫酸钠标准溶液滴定锥形瓶中的溶液(I2+2S2O32-=2I- +S4O62-),指示剂显示终点时共用去20.00mL硫代硫酸钠溶液。在此过程中:
①锥形瓶内ClO2与碘化钾反应的离子方程式为 。
②玻璃液封装置的作用是 。
③V中加入的指示剂通常为 ,滴定至终点的现象是 。
④测得混合气体中ClO2的质量为 g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com