
下列不能说明氯元素的非金属性比硫元素强的事实是( A )
①HCl比H2S稳定 ②HClO氧化性比H2SO4强 ③HClO4酸性比H2SO4强 ④Cl2能与H2S反应生成S ⑤氯原子最外层有7个电子,硫原子最外层有6个电子
A.②⑤ B.①②
C.①②④ D.①③⑤
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值,下列有关叙述正确的是
A.28 g乙烯和28g丙烯中均含有6NA对共用电子对
B.标准状况下,2.24L氯仿中含有C-Cl数目为0.3NA
C.标准状况下,560 mL甲烷和甲醛的混合气体中,含有的共用电子对数为0.2NA
D.11.2L乙烯、乙炔的混合物中C原子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,在恒容密闭容器中发生如下反应:2A(g)+B(g)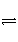
 3C(g),若反应开始
3C(g),若反应开始
时充入2 mol A和2 mol B,达平衡后A的体积分数为a%。其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%的是( )
A.1 mol B和3 mol C
B.2 mol A、1mol B和1 mol He(不参加反应)
C.1 mol B和1 mol C
D.2 mol A、3mol B和3 mol C
查看答案和解析>>
科目:高中化学 来源: 题型:
某氮肥厂氨氮废水中的氮元素多以NH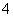 和NH3·H2O的形式存在,该废水的处理流程如下:
和NH3·H2O的形式存在,该废水的处理流程如下:

(1)过程Ⅰ:加NaOH溶液,调节pH至9后,升温至30℃,通空气将氨赶出并回收。
①用离子方程式表示加NaOH溶液的作用:
________________________________________________________________________。
②用化学平衡原理解释通空气的目的:
________________________________________________________________________。
(2)过程Ⅱ:在微生物作用的条件下,NH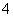 经过两步反应被氧化成NO
经过两步反应被氧化成NO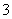 。两步反应的能量变化示意图如下:
。两步反应的能量变化示意图如下:
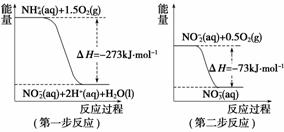
① 第一步反应是________反应(选填“放热”或“吸热”),判断依据是
________________________________________________________________________。
②1 mol NH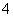 (aq)全部氧化成NO
(aq)全部氧化成NO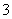 (aq)的热化学方程式是
(aq)的热化学方程式是
________________________________________________________________________。
(3)过程Ⅲ:一定条件下,向废水中加入CH3OH,将HNO3还原成N2。若该反应消耗32 g CH3OH,转移6 mol电子,则参加反应的还原剂和氧化剂的物质的量之比是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关碱金属的说法中,不正确的是( )
A.IA族元素都是碱金属元素
B.K的还原性强于Na
C.Na和Na+灼烧时都能使火焰呈黄色
D.Na在空气中燃烧时生成Na2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
对于放热反应H2+Cl2 2HCl,下列说法中,正确的是( )
2HCl,下列说法中,正确的是( )
A.产物所具有的总能量高于反应物所具有的总能量
B.反应物所具有的总能量高于产物所具有的总能量
C.断开1 mol H-H键和1 mol Cl-Cl键所吸收的总能量大于形成1mol H-Cl键所放出的能量
D.该反应中,化学能只转变为热能
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作均要用玻璃棒,其中玻璃棒的作用及其目的相同的是 ( )
① 过滤 ② 蒸发 ③ 溶解 ④ 向容量瓶转移液体
A.①和② B.①和④ C.③和④ D.①和③
查看答案和解析>>
科目:高中化学 来源: 题型:
已知反应:2NO2(g)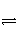
 N2O4(g)是放热反应,为了探究温度对化学平衡的影响,有人做了如下实验:把NO2和N2O4的混合气体通入甲、乙两个连通的烧瓶里,然后用夹子夹住橡皮管,把两烧瓶分别浸入两个分别盛有500 mL 6 mol·L-1的HCl溶液和盛有500 mL蒸馏水的烧杯中(两烧杯中溶液的温度相同)。
N2O4(g)是放热反应,为了探究温度对化学平衡的影响,有人做了如下实验:把NO2和N2O4的混合气体通入甲、乙两个连通的烧瓶里,然后用夹子夹住橡皮管,把两烧瓶分别浸入两个分别盛有500 mL 6 mol·L-1的HCl溶液和盛有500 mL蒸馏水的烧杯中(两烧杯中溶液的温度相同)。
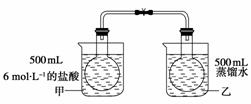
该实验用两个经导管连通的烧瓶,其设计意图是
________________________________________________________________________
________________________________________________________________________。
向烧杯甲的溶液中放入125 g NaOH固体,同时向烧杯乙中放入125 g硝酸铵晶体,搅拌使之溶解。甲烧瓶内气体的颜色将____________,原因是
________________________________________________________________________
________________________________________________________________________;
乙烧瓶内气体的颜色将__________,原因是
________________________________________________________________________
________________________________________________________________________。
该实验欲得出的结论是
________________________________________________________________________
________________________________________________________________________。
(4)某同学认为该实验的设计并不完全科学,他指出此时影响化学平衡的因素不止一个,你认为他所指的另一个因素是______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com