
| A����X�ķ�Ӧ����Ϊ0.2 mol?L-1?s-1����Z�ķ�Ӧ����Ϊ0.3 mol?L-1?s-1 |
| B�����������г��뺤����ѹǿ����Y��ת������� |
| C�������¶ȣ�����Ӧ���ʼ�С��ƽ�����淴Ӧ�����ƶ� |
| D����ʼ���������е�X��Y���ʵ���֮��Ϊ2��1 |
| 0.4 |
| 3 |
| 3a |
| x |
| a |
| y |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����ϩͨ�����Ը��������Һ�У����Ը��������Һ��ɫ |
| B����һ�������£�����������Ӧ���ɻ����� |
| C����һ�������£�������Ũ�����Ũ����Ļ��Һ�У�����״������ |
| D���ڴ��������£���ϩ���Ӽ䷢���ӳɾۺϷ�Ӧ���ɸ߷��Ӿ���ϩ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A��
| ||
B��
| ||
C��
| ||
D��
|
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�����ۼ��ı��������ɳɼ�ԭ�ӵ�δ�ɶԵ����������� |
| B�����ۼ��ķ��������ɳɼ�ԭ�ӵĹ���ķ�������� |
| C�����ۼ��ı�������ԭ�ӹ�����ص��̶��й� |
| D�����ۼ��ķ����Ծ����˷��ӵ����幹�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�����ʯ��ʯī |
B��CH3-CH2-CH2-CH3��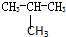 |
| C��CH4��C2H6 |
| D��16O��18O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ���� | �� | �� | �� |
| ��Ӧ��Ͷ���� | 1mol N2��3mol H2 | 2mol N2��6mol H2 | 2mol NH3 |
| NH3��Ũ�ȣ�mol?L-1�� | c1 | c2 | c3 |
| ��Ӧ�������仯 | �ų�Q1 kJ | �ų�Q2 kJ | ����Q3 kJ |
| ��ϵѹǿ��Pa�� | p1 | p2 | p3 |
| ��Ӧ��ת���� | ��1 | ��2 | ��3 |
| A��Q3+92.4c1=92.4 |
| B����2+��3��1 |
| C��2p1=2p3��p2 |
| D���ﵽƽ��ʱ��������NH3������������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����ú������ȼ�� |
| B����2mol/L���������0.1mol/L�����ᷴӦ������ |
| C���ù���������Һ������ʱ���������������̷�ĩ |
| D����ʳ�������ڱ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�����µĺϽ���� |
| B����ũҩ��Ԫ�� |
| C�����뵼����ϵ�Ԫ�� |
| D����������Ԫ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 �����ǵ�ѭ���е���Ҫ���ʣ�����������������������Ź㷺��Ӧ�ã�
�����ǵ�ѭ���е���Ҫ���ʣ�����������������������Ź㷺��Ӧ�ã��鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com