
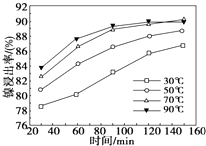
 镍及其化合物具有优良的物理和化学特性,是许多领域尤其是高技术产业的重要原料.回答下列问题:
镍及其化合物具有优良的物理和化学特性,是许多领域尤其是高技术产业的重要原料.回答下列问题:分析 (1)分析反应中元素化合价变化,依据方程式判断当两个反应转移相同电子,消耗的氯化氢和生成气体的物质的量;
(2)①根据镍浸出率随时间变化图可知,70℃时,镍浸出率很大,从时间看,120min镍浸出率已经很高,再延长时间对浸出率提高幅度很小;根据温度的升高对进出率的影响来分析;
②反应中铁元素化合价从+3升高为8-n价,化合价升高5-n价,氯元素从+1价降为-1价,化合价降了2价,依据氧化还原反应化合价升降数目相等结合原子个数守恒配平方程式;
(3)依据题意:La为镧元素,LaNi5H6中各元素化合价均可看作是零判断氢元素化合价;此电池放电时的反应为LaNi5H6+6NiOH=LaNi5+6Ni(OH)2,正极反应为6NiOOH+6e-=6Ni(OH)2+6OH-,负极反应为 LaNi5H6-6e-+6OH-=LaNi5+6H2O.由此可见储氢合金是还原剂,作原电池的负极
,充电时电解池阴极对应原电池负极,发生还原反应,据此书写充电时阴极电极反应式;
(4)①依据溶度积规则计算解答;
②根据消耗Fe2+的物质的量求出样品中含有的NiO(OH)的物质的量和质量,然后用样品的质量减去NiO(OH)的质量即得Ni(OH)2的质量和物质的量,即可求出x:y的值.
解答 解:(1)①Ni+2HCl═NiCl2+H2↑,Ni由0价升高到NiCl2中+2价,转移2mol电子消耗2mol氯化氢,生成1mol氢气;
②NiO2+4HCl═NiCl2+Cl2↑+2H2O,NiO2由+4价降为NiCl2中+2价,转移2mol电子消耗4mol氯化氢,生成1mol氯气;
所以两个反应转移相同电子数时,消耗HCl的物质的量比为:1:2;生成气体的物质的量比为1:1;
故答案为:1:2;1:1;
(2)①根据镍浸出率随时间变化图可知,70℃时,镍浸出率很大,从时间看,120min时镍浸出率已经很高,再延长时间对镍浸出率没有实质性提高,选择70℃和120min为宜;在70℃时,Ni的进出率已经达到90%,再升高温度进出率的升高空间不大;
故答案为:70;120;70℃时,Ni的进出率已达90%,故升高温度进出率变化不大;
②反应中铁元素化合价从+3升高为8-n价,化合价升高5-n价,氯元素从+1价降为-1价,化合价降了2价,要使化合价升降数目相等则:氢氧化铁系数为2,次氯酸根离子系数为5-n,依据原子个数守恒得:2Fe(OH)3+(5-n)ClO-+2nOH-=2FeO4n-+(5-n)Cl-+(n+3)H2O;
故答案为:2;(5-n);2n;2;(5-n);(n+3);
(3)依据题意:La为镧元素,LaNi5H6中各元素化合价均可看作是零,所以氢元素化合价为0;此电池放电时的反应为LaNi5H6+6NiOH=LaNi5+6Ni(OH)2,正极反应为6NiOOH+6e-=6Ni(OH)2+6OH-,负极反应为 LaNi5H6-6e-+6OH-=LaNi5+6H2O.由此可见储氢合金是还原剂,作原电池的负极,充电时电解池阴极对应原电池负极,发生还原反应,阴极反应为LaNi5+6H2O-6e-=LaNi5H6+6OH-;
故答案为:0;LaNi5+6H2O-6e-=LaNi5H6+6OH-;
(4)①当Ni2+完全沉淀 (Ni2+浓度小于1×10-5mol/L) 时,则满足c(Ni2+)×c2(OH-)=Ksp[Ni(OH)2],即1×10-5×c2(OH-)=1.6×10-14,解得c(OH-)=4×10-5,c(H+)=$\frac{10{\;}^{-14}}{4×10{\;}^{-5}}$=2.5×10-10mo/L,则pH=-lg2.5×10-10=9.7,故答案为:9.7;
②反应消耗Fe2+的物质的量n=0.01L×1mol/L=0.01mol,设样品中含有的NiO(OH)的物质的量为amol,则有:
NiO(OH)~Fe2+
1 1
amol 0.01mol
故有:$\frac{1}{amol}=\frac{1}{0.01mol}$
解得a=0.01mol
则样品中含有的NiO(OH) 的质量m=0.01mol×92g/mol=0.92g
则样品中含有的Ni(OH)2的质量m=1.013g-0.92g=0.093g
物质的量n=$\frac{0.093g}{93g/mol}$=0.001mol
则NiO(OH) 和Ni(OH)2的物质的量之比为0.01mol:0.001mol=10:1=x:y
故答案为:10:1.
点评 本题考查了物质分离方法和实验过程分析判断,溶度积常数和离子积常数的计算应用以及滴定过程的计算,注意流程的理解应用,掌握实验基础和物质性质是关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
 如图所示装置可构成原电池.试回答下列问题:
如图所示装置可构成原电池.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 | 操作 | |
| A | 配制0.1mol•L-1氯化铝溶液 | 先将氯化铝晶体溶于浓盐酸中,后加蒸馏水稀释至指定体积 |
| B | 在加热条先下氢气还原氧化铜 | 反应完成后,先停止通入氢气,后停止加热 |
| C | 浓盐酸与碳酸钙反应制备CO2 | 气体产物先通过浓硫酸,后通过饱和碳酸氢钠溶液 |
| D | 检验某溶液是否含SO42- | 先加入BaCl2溶液,后加入盐酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| T/K | T1 | T2 | T3 |
| K | 1.00×107 | 2.54×105 | 1.88×103 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 2molH2、2molN2 | 4molH2、4molN2 | 2molNH3 |
| 平衡时N2的浓度(mol•L-1) | c1 | 1.5 | C3 |
| N2的体积分数 | w 1 | w 2 | w 3 |
| 混合气体的密度(g•L-1) | ?ρ1 | ?ρ2 | ?ρ3? |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 磷化氢气体(PH3)是一种强烈的储粮害虫杀剂,其制取原理类似于实验室制氨气,空气中磷化氢气体达到2PPM以上是就会造成人畜中毒,请回答:
磷化氢气体(PH3)是一种强烈的储粮害虫杀剂,其制取原理类似于实验室制氨气,空气中磷化氢气体达到2PPM以上是就会造成人畜中毒,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com