
| A. | 水华、赤潮等水体污染与大量排放硫、氮氧化物有关 | |
| B. | 淀粉可以作为阿司匹林、去痛片等药片的黏合材料 | |
| C. | 硅胶常用作袋装食品'瓶装药品的干燥剂 | |
| D. | 绿色化学的核心是利用化学原理从源头上减少和消除污染 |
分析 A.含N、P的大量污水任意排向湖泊和近海,会造成水体的富营养化,会出现水华、赤潮等水体污染;
B.药物中添加淀粉,以作为粘合剂;
C.硅胶具有吸水性,且无毒;
D.绿色化学是指化学反应过程中以“原子经济性”为基本原则,即在获取新物质的化学反应中充分利用参与反应的每个原料原子,实现“零排放”,不仅充分利用资源,而且不产生污染.
解答 解:A.水华、赤潮等水体污染与大量排放氮、磷有关,与硫的排放无关,故A错误;
B.一般来说,药物的主要成分为淀粉,药物中添加淀粉,以作为粘合剂,同时降低剂量,避免药物中毒,故B正确;
C.硅胶具有吸水性,且无毒,常用于食品干燥剂,故C正确;
D.绿色化学的核心是要利用化学原理从源头上减少和消除工业生产对环境的污染,以便使化学在环境保护中起到重要作用,故D正确;
故选:A.
点评 本题考查较为综合,侧重于化学与生活、生产的考查,有利于培养学生良好的科学素养,明确物质组成、性质、用途关系是解本题关键,注意明确绿色化学的概念及核心.


 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案科目:高中化学 来源: 题型:解答题
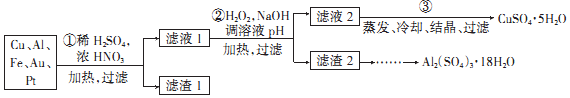
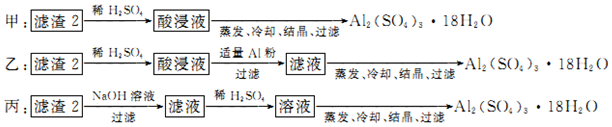
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ④③①⑤ | B. | ②③⑤① | C. | ④⑥③① | D. | ④⑤⑥③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 乙酸橙花酯兼有橙花和玫瑰花香气,其结构简式如图.关于该有机物的叙述中正确的是
乙酸橙花酯兼有橙花和玫瑰花香气,其结构简式如图.关于该有机物的叙述中正确的是| A. | ②④⑤ | B. | ①④⑤ | C. | ②③⑤ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 测定中和反应反应热实验中,为了充分反应,应将NaOH溶液缓缓倒入盐酸中 | |
| B. | 配制FeCl3溶液时,将FeCl3,晶体溶解在较浓的盐酸中,再加蒸馏水稀释到所需浓度 | |
| C. | 用盐酸滴定NaOH溶液时,左手控制酸式滴定管活塞,右手振荡锥形瓶,眼睛注视滴定管内液面 | |
| D. | 检验Fe(NOs)2晶体是否变质时,将Fe(NO3)2样品溶于稀H2SO4后,再滴加KSCN溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.6g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA | |
| B. | 0.1 mol丙烯酸(CH2=CHCOOH)中含有碳原子的数目为0.2NA | |
| C. | 标准状况下,11.2LCCl4中含有分子的数目为0.5NA | |
| D. | 在2Na2O2+2H2O═4NaOH+O2↑的反应中,每生成0.1 mol氧气,转移电子的数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在中和反应未完成前随着NaOH溶液的滴加,-OOCCH2COO-的物质的量浓度逐渐升高 | |
| B. | 若滴入的NaOH溶液的体积=10mL时溶液温度最高,则丙二酸的物质的量浓度=0.1mol•L-1 | |
| C. | 在丙二酸未完全中和前,随着NaOH的滴加,水的电离程度逐渐增大 | |
| D. | 若忽略丙二酸氢根离子的电离和水解,丙二酸根离子的水解常数约为7.14×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4NO+2H2O+3O2═4HNO3化合反应 | |
| B. | Cu(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CuO+H2O 分解反应 | |
| C. | CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O置换反应 | |
| D. | CaCO3+2HCl═CaCl2+H2O+CO2↑复分解反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com