【答案】
分析:X元素的原子形成的离子就是一个质子,则X为氢元素;Y原子的最外层电子数是内层电子数的2倍,若Y为2个电子层,则Y为碳元素;X、Y、Z、W、M五种元素的原子序数依次增大,Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体,则Z为氮元素,W为氧元素;M是地壳中含量最高的金属元素,则M为铝元素;
(1)根据铝的原子结构来分析位置,利用电子层数及同周期半径的比较规律来分析;
(2)Z、X两元素按原子数目比1:3和2:4构成分子为氨气和肼,利用最外层电子数来分析;
(3)根据Se与O同族,Se原子比O原子多两个电子层来推断Se的原子序数,由最高价为+6价来书写最高价氧化物对应的水化物,该族2~5周期元素单质分别与H
2反应放出的热量与非金属单质的活泼性有关;
(4)铝作阳极,则铝失去电子,NaHCO
3溶液作电解液进行电解,生成难溶物R,R受热分解生成化合物Q,则R为氢氧化铝,然后书写电极反应式.
解答:解:X元素的原子形成的离子就是一个质子,则X为氢元素;Y原子的最外层电子数是内层电子数的2倍,若Y为2个电子层,则Y为碳元素;X、Y、Z、W、M五种元素的原子序数依次增大,Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体,则Z为氮元素,W为氧元素;M是地壳中含量最高的金属元素,则M为铝元素;
(1)铝的原子结构中有三个电子层,最外层电子数为3,则铝在元素周期表中第3周期第ⅢA族,五种元素只有铝有三个电子层,半径最大,氢有1个电子层,半径最小,C、N、O都位于第二周期,原子序数越大半径越小,则半径大小为Al>C>N>O>H,故答案为:第3周期第ⅢA族;Al>C>N>O>H;
(2)Z、X两元素按原子数目比1:3和2:4构成分子为氨气和肼,N原子最外层5个电子,则氨气的电子式为
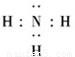
,肼的结构式为
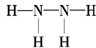
,
故答案为:
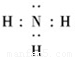
;

;
(3)Se与O同族,Se原子比O原子多两个电子层,则Se的原子序数为8+8+18=34,其最高价为+6价,与H
2SO
4相似,则最高价氧化物对应的水化物化学式为H
2SeO
4,该族2~5周期元素单质的活泼性氧气>硫>硒>碲,单质越活泼生成1mol氢化物放出的热量越大,则表示生成1mol硒化氢反应热的b,故答案为:34;H
2SeO
4;b;
(4)铝作阳极,则铝失去电子,难溶物R,R受热分解生成化合物Q,则R为氢氧化铝,在阳极NaHCO
3溶液参与反应,则电极反应为Al-3e
-+HCO
3-═Al(OH)
3↓+3CO
2↑,
故答案为:Al-3e
-+HCO
3-═Al(OH)
3↓+3CO
2↑.
点评:本题考查利用原子结构来推断元素,然后结合元素化合物知识及基本概念和基本理论来解答,注重了对高考热点的考查,并学会利用类推的方法来解题.

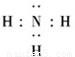 ,肼的结构式为
,肼的结构式为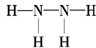 ,
,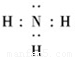 ;
; ;
;


