
【题目】下图为几种晶体或晶胞的示意图:
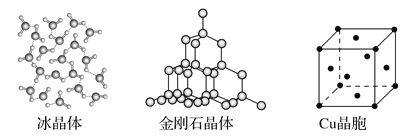
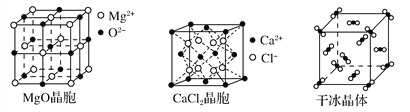
请回答下列问题:
(1)上述晶体中,粒子之间以共价键结合形成的晶体是________。
(2)冰、金刚石、MgO、CaCl2、干冰5种晶体的熔点由高到低的顺序为________________________。
(3)NaCl晶胞与MgO晶胞相同,NaCl晶体的晶格能______(填“大于”或“小于”)MgO晶体,原因是________________________________________________。
(4)每个Cu晶胞中实际占有________个Cu原子,CaCl2晶体中Ca2+的配位数为________。
(5)冰的熔点远高于干冰,除H2O是极性分子、CO2是非极性分子外,还有一个重要的原因是____________________________________。
【答案】 金刚石晶体 金刚石>MgO>CaCl2>冰>干冰 小于 MgO晶体中离子的电荷数大于NaCl晶体中离子电荷数;且r(Mg2+)<r(Na+)、r(O2-)<r(Cl-) 4 8 H2O分子之间能形成氢键
【解析】本题主要考查晶体结构。
(1)上述晶体中,粒子之间以共价键结合形成的晶体是属于原子晶体的金刚石晶体。
(2)一般地,熔点:原子晶体>离子晶体>分子之间形成氢键的分子晶体>不存在氢键的分子晶体,离子晶体中的离子半径越小、离子所带电荷越多,离子晶体的熔点越高,所以冰、金刚石、MgO、CaCl2、干冰5种晶体的熔点由高到低的顺序为金刚石>MgO>CaCl2>冰>干冰。
(3)NaCl晶胞与MgO晶胞相同,NaCl晶体的晶格能小于MgO晶体,原因是MgO晶体中离子的电荷数大于NaCl晶体中离子电荷数;且r(Mg2+)<r(Na+)、r(O2-)<r(Cl-)。
(4)每个Cu晶胞中实际占有4个Cu原子,CaCl2晶体中Ca2+的配位数为8。
(5)冰的熔点远高于干冰,除H2O是极性分子、CO2是非极性分子外,还有一个重要的原因是H2O分子之间能形成氢键。


科目:高中化学 来源: 题型:
【题目】下列关于原子结构的表述中,正确的是( )
A.L能层含轨道数共有8个
B.在基态K原子中,核外电子占据最高能级符合为N
C.电子云轮廓图半径随能层序数增加而增大
D.根据洪特规则每个轨道最多容纳2个自旋状态相反的电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮(N)、磷(P)、砷(As)等都是VA族元素,该族元素的化合物在研究和生产中有许多重要用途。回答下列问题:
(1)As原子的价电子排布式为____________。
(2)P和S是同一周期的两种元素,P的第一电离能比S大,原因是________________。
(3)NH4+中H—N—H的键角比NH3分子中的键角________(填“大”或“小”),原因是____________。
(4)NaAsO4中含有的化学键类型包括__________;AsO43-的空间构型为_____________;As4O6的分子结构如下图所示,则在该化合物中As原子的杂化方式是____________。

(5)2017年1月27日,我国科学家在《Science》杂质上发表论文,在全氮阴离子盐合成上取得重大进展,首次制得试问下稳定,含有N5-离子的盐(具有超高能量密度的化合物),N5-离子中氮元素的平均化合价为_____。
(6)白磷(P)的晶体属于分子晶体,其晶胞结构如下图(小圆圈表示白磷分子)。该晶胞中含有的P原子数为_______;已知该晶胞的边长为a cm,阿伏加德罗常数为NAmol-1,则该晶体的密度为_____g·cm-3(用含有NA的式子表示)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高倩同学在做实验时引发了镁失火,她立即拿起二氧化碳灭火器欲把火扑灭,却被实验老师及时制止。原因是CO2可以支持镁燃烧发生以下反应:2Mg+CO2![]() 2MgO+C,下列关于该反应的判断正确的是( )
2MgO+C,下列关于该反应的判断正确的是( )
A. Mg元素化合价由0价升高到+2价,所以MgO是还原产物
B. 由此反应可以判断氧化性CO2>MgO,还原性Mg>C
C. CO2作氧化剂,表现氧化性,发生氧化反应
D. Mg原子失去的电子数目等于氧原子得到的电子数目
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取体积相同的KI、Na2SO3、FeBr2溶液,分别通入足量氯气,当恰好完全反应时,三种溶液消耗氯气的物质的量相同,则KI、Na2SO3、FeBr2溶液的物质的量浓度之比为( )
A. 2:1:2 B. 2:1:3
C. 6:3:2 D. 3:7:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国最新报导的高超导体中,铊(Tl)是其中之一,已知位于第六周期第ⅢA族,关于铊的说法,可能错误的是:
A. 是银白色金属 B. Tl(OH)3有两性
C. 与稀盐酸反应生成盐酸盐 D. 铊的金属性强于铝的金属性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 石油裂解、煤的气化、海水制镁等过程中都包含化学变化
B. 可电解熔融MgCl2来制取金属镁,也能电解熔融AlCl3来制取铝
C. 铝热剂、盐酸、水玻璃、过氧化氢、明矾均为混合物
D. Na2O2、MgCl2、NaOH、NH4Cl均为含共价键的离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组同学为了探究“在相同的温度和压强下,相同体积的任何气体都含有相同数目的分子”,他们以教材中相关【科学探究】为基础,设计了如下实验装置并记录相关实验数据。
【实验装置】

【部分实验数据】
温度 | 压强 | 时间 | 水槽中H2O的质量 | H2体积 | O2体积 |
30 ℃ | 101 kPa | 0 | 300 g | 0 | 0 |
30 ℃ | 101 kPa | 4分钟 | 298.2 g | 1.243 L |
请回答下列问题:
(1)4分钟时H2、O2的物质的量分别是________mol、________mol。
(2)该温度下,气体摩尔体积是__________。
(3)下列叙述不正确的是________。
A.气体摩尔体积与气体的温度相关
B.在该实验条件下,3 mol O2的气体摩尔体积为74.58 L·mol-1
C.同温、同压下,2 mol CO、CO2混合气体和2 mol O2的体积相同
D.该实验条件下,O2的密度为1.287 g·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中和相同体积相同pH值的Ba(OH)2,NaOH和NH3H2O三种稀溶液所用相同浓度盐酸的体积分别是V1,V2,V3,它们的关系是 ( )
A. V3>V2>V1 B. V3>V2=V1 C. V3=V2>V1 D. V1=V2>V3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com